Multi-view Multichannel Attention Graph Convolutional Network for miRNA–disease association prediction | Briefings in Bioinformatics | Oxford AcademicAbstract. Motivation: In recent years, a growing number of studies have proved that microRNAs (miRNAs) play significant roles in the development of human comple![]() https://academic.oup.com/bib/article/22/6/bbab174/6271996MMGCN : Multi-view Multichannel Attention Graph Convolutional Network for miRNA–disease association prediction
https://academic.oup.com/bib/article/22/6/bbab174/6271996MMGCN : Multi-view Multichannel Attention Graph Convolutional Network for miRNA–disease association prediction
![]()
![]()
目录
3.2.相似性度量(Similarity measures)
3.2.1.miRNA序列相似性(MiRNA sequence similarity)
3.2.3.疾病语义相似度(Disease semantic similarity)
3.2.4.基于靶标的疾病相似度度量(Target-based similarity measure for diseases)
3.3.多视图GCN编码器(Multiview GCN encoder)
3.4.多通道注意力(Multichannel attention)
3.6.miRNA与疾病的关联预测(Association prediction for miRNA and disease)
4.4.性能比较(Performance comparison)
4.6.不同视图融合的性能 (Performance of different view fusion)
4.7.MMGCN的参数分析(Parameter analysis of MMGCN)
4.7.3.过滤器数量(Number of filters)
1.摘要(Abstract)
动机:近年来,越来越多的研究证明microRNAs(miRNAs)在人类复杂疾病的发展中起着重要作用。 发现miRNAs与疾病的关系已成为疾病发现和治疗的重要组成部分。 由于传统的实验方法发现关联是复杂和耗时的,许多计算方法被提出来识别潜在的关联。 然而,利用多源数据准确确定miRNA与疾病之间的潜在关联仍存在挑战。
结果:在本研究中,我们开发了一个多视点多通道注意图卷积网络(MMGCN)来预测潜在的miRNA与疾病的关联。 与简单的多源信息集成不同,MMGCN采用GCN编码器分别获取不同相似性视图下的miRNA和疾病特征。 此外,我们的MMGCN可以利用多通道注意力来增强已学习的潜在表征,从而自适应地学习不同特征的重要性。 在两个数据集上的实证结果表明,MMGCN模型在大多数指标上都能取得优于现有九种方法的性能。 此外,我们还证明了多通道注意机制的有效性和多源数据在miRNA和疾病关联预测中的有效性。 案例研究也表明了该方法发现新关联的能力。
关键词:miRNA与疾病相关性; 多视图; 图卷积网络; 深度学习
2.引言(Introduction)
MicroRNAs(miRNAs)是一类内源性的小分子非编码RNAs,在细胞发育、增殖分化、免疫反应等多种生物学过程中起着重要作用[1-3]。 它们的异常表达可直接或间接引起其调控靶基因表达水平的改变,导致复杂疾病[4-6]。因此,要了解疾病的发病机制,有必要确定 miRNA 与疾病之间的更多关联。
目前,qPT-PCR[7]和Northern blot[8]等湿实验方法都能通过反映细胞内miRNA的真实表达水平来鉴定与疾病相关的miRNA。然而,通过生物学实验确定 miRNA 与疾病之间的关联是耗时和昂贵的[9]。因此,有必要发展计算方法来识别与疾病相关的miRNAs。 根据以往的研究[10],现有的计算方法可以分为两大类,即基于相似性度量的方法和基于机器学习的方法。
基于相似性的方法是基于这样一个假设,即具有相似性功能的miRNAs更有可能与相似的疾病相关,反之亦然。 为了更好地利用已知信息,Jiang等人[11]将miRNA-疾病关联预测问题看作miRNA-疾病网络上的链路预测问题。 学者们提出了第一个使用离散的超几何概率分布来识别miRNA与疾病关联的计算方法。 后来,为了取得更好的预测结果,Xuan等人[12]设计了一个计算模型HDMP来评估K个功能最相似的邻居,以探索miRNAs与疾病相关的可能性。 然而,上述方法只考虑了网络中的直接边缘信息,而忽略了网络的全局结构。 在全局网络信息的基础上,一些研究者[13-15]使用随机游走和重启算法来预测miRNA与疾病的关联。 虽然许多尝试在寻找新的关联方面取得了显著的效果,但对于那些已知相关的miRNAs很少或根本没有的疾病,大多数方法都不能推断出潜在相关的miRNAs。 为了解决这个问题,人们提出了许多新的方法,NetGS[9]利用全局网络的相似性,利用扩散谱的一致性来捕捉疾病与miRNAs之间的关系。 它能以可靠的精度解决新的miRNA与疾病关联预测问题。而且,Xiao等人 [16]提出了一种图正则化的非负矩阵分解方法,该方法可以有效地推断那些新疾病和miRNAs的未知miRNA-疾病关联。 然而,它存在着对邻域信息敏感和对输入数据源依赖性强的问题。 为此,Zhang等人[17]提出了一个模型,该模型能够自适应地学习每个节点的邻居信息,以更新节点的潜在因子,进一步提高对潜在链路预测的有效性。 尽管这些基于相似性的模型表现良好,但仍然难以捕捉miRNAs与疾病网络之间的许多复杂和非线性关系。
近年来,基于机器学习的模型被提出来更好地提取特征,从而提高预测性能。 Chen等人先后提出了归纳矩阵补全法(IMCMDA)[18]和集成学习法(EDTMDA)[19]来学习网络间复杂的非线性关系。然而,随着近年来关联数据的快速增长,传统的机器学习算法已经不能适应复杂多变的数据。 深度学习方法以其快速高效地处理非结构化数据的能力,在生物信息学中得到了广泛的应用。 例如,CNNMDA[20]利用双卷积神经网络(CNN)来学习miRNA-疾病对的原始和全局表示。 为了克服“灾难性遗忘”的问题,MISSIM[21]首次将增量学习引入生物关联预测领域,并在miRNA疾病关联预测任务上取得了优越的性能。 而基于图的方法,如GCN[22]、GAT[23]等,可以利用上下文信息使模型具有出色的性能。现在有一些研究利用图形神经网络来学习节点的上下文表示,如 GCN-MF [24] ,IDDkin [25] ,GAERF [26] ,GCNCDA [27] ,它们都取得了优异的性能。然而,大多数模型只是使用单个信息或执行简单的信息填充来集成多个信息源。 如何有效地利用多源信息来提高预测的准确性仍然是一个挑战。 最近的研究[28-30]表明,多源信息的融合在生物领域中得到了广泛的应用。 例如,MDA-SKF[31]是一种基于相似性核融合的方法,用于整合miRNA和疾病的多个相似性核。 但是,MDA-SKF忽略了图中的上下文信息。 为了更好地学习节点特征,NeoDTI[32]从异构网络数据中整合了不同的信息,并使用图神经网络自动学习药物和靶点的拓扑保持表示。 IMDA-BN[33]综合了9种关系类型,利用图嵌入算法获得了用于miRNA与疾病相互作用预测的节点的网络嵌入表示。 将多源信息整合到 miRNA 与疾病的关联预测中,可以提高预测的性能。 此外,不同信息对预测任务的贡献不一定相同[34]。 因此,提出一种自适应学习多视图特征的方法可能为MIRNA疾病关联预测提供一个新的视角。
在本研究中,我们提出了一个多视点多通道注意力图卷积网络MMGCN用于miRNA与疾病的关联预测。 首先,我们利用图卷积网络(GCN)分别从miRNA和疾病的多个相似度网络中学习它们的多视图特征。 其次,不是简单地集成多源信息,而是在多个特征上利用注意力机制自适应地学习不同特征的重要性。 然后利用CNN合并器得到最终的嵌入。 最后,我们将疾病相关的miRNA识别问题视为一个推荐任务,并使用矩阵补全来预测潜在的miRNA与疾病的关联。 为了评估MMGCN的有效性,我们在两个基准数据集上,在10次5折交叉验证下,将其与一些现有方法进行了比较。 此外,为了论证每个阶段的必要性,我们进行了消融研究,并在不同的视角下比较了我们的方法的结果。 最后,通过案例研究来说明MMGCN在发现疾病与miRNAs之间的新关联方面的强大预测能力。
3.方法(Method)
3.1.模型框架(Model framework)
在这一节中,我们提出了一个新的多视图深度学习框架MMGCN来预测miRNA与疾病的关联。 通过融合miRNA和疾病的多源相似性视图,将miRNA疾病预测问题框架化为一个推荐任务。 更具体地说,如图1所示,MMGCN是一个端到端模型,由以下三个模块组成:(i)用于编码miRNAs和疾病多源数据的多视图GCN编码器(图1A)。 (ii)多通道注意力机制分别学习不同通道信息(从GCN编码器学习的miRNA和疾病的通道信息)的重要性(图1B和C)。 (iii)一个CNN组合器,它重组来自多通道注意力模块的特征,以获得miRNA和疾病的统一嵌入(图1D)。 在分别获得 miRNA 和疾病的特征嵌入后,我们使用矩阵分解来获得 miRNA 和疾病的潜在相关矩阵。

3.2.相似性度量(Similarity measures)
在这一节中,我们利用多种生物学数据源来综合表征miRNAs和疾病的相似性视图,这些相似性视图将在下面详细计算。
3.2.1.miRNA序列相似性(MiRNA sequence similarity)
我们利用Needleman-Wunsch算法[35]求出了miRNA种子区序列相似矩阵![]() 。为了保证全局一致性,我们得到
。为了保证全局一致性,我们得到![]() 之间的归一化关系
之间的归一化关系![]() ,如下所示:
,如下所示:
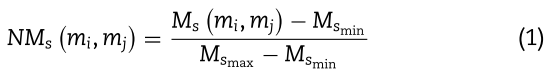
其中![]() 分别表示miRNA序列相似度矩阵
分别表示miRNA序列相似度矩阵![]() 中的最小值和最大值。 然后,miRNAs
中的最小值和最大值。 然后,miRNAs ![]() 之间的序列相似性可以写如下:
之间的序列相似性可以写如下:
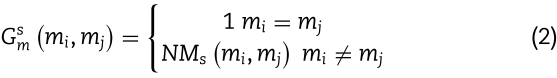
![]() ,可以看作是miRNAs的一个序列视图,其中
,可以看作是miRNAs的一个序列视图,其中![]() 表示miRNAs的个数。
表示miRNAs的个数。
3.2.2.miRNA功能相似性(miRNA功能相似性)
为了避免依赖于现有的miRNA与疾病之间的关联,我们遵循以前的工作[16],使用miRNA与基因之间的关联来计算miRNA的功能相似性。
基因功能相互作用网络是由HumanNet[36]得到的,它包含了基因间功能连锁的概率。 它被称为对数似然分数(LLS)。 我们首先通过对LLS进行最小-最大归一化来获得基因之间的相似性![]() 。 并且基因相似图定义如下:
。 并且基因相似图定义如下:
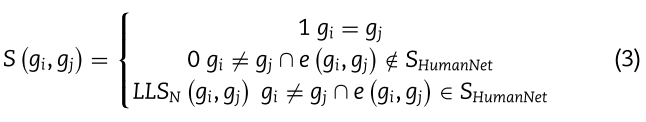
其中![]() 包含HumanNet中的所有链接;
包含HumanNet中的所有链接; ![]() 是基因
是基因![]() 之间的边。 然后,我们计算一个基因
之间的边。 然后,我们计算一个基因![]() 与一组基因
与一组基因![]() 的相似度得分,如下:
的相似度得分,如下:
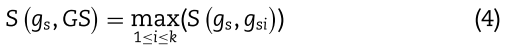
随后,我们可以通过方程(5)得到miRNAs ![]() 之间的功能相似性。
之间的功能相似性。
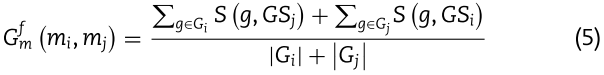
其中![]() 分别代表与miRNAs
分别代表与miRNAs ![]() 相关的相应基因集。 最后,我们得到了miRNA功能相似度视图
相关的相应基因集。 最后,我们得到了miRNA功能相似度视图![]() 。
。
3.2.3.疾病语义相似度(Disease semantic similarity)
为了描述疾病之间的关系,我们使用有向无环图(DAG)来计算它们之间的语义相似性和Wang等人方法相似[37]。 因此,疾病 d 的DAG图可以定义为![]() ,其中
,其中![]() 表示包含d的 疾病d 所有祖先的疾病集,而
表示包含d的 疾病d 所有祖先的疾病集,而![]() 是 d 的DAG图的边集。 因此,DAG(d)中疾病 t 对疾病 d 的语义贡献可以计算如下:
是 d 的DAG图的边集。 因此,DAG(d)中疾病 t 对疾病 d 的语义贡献可以计算如下:
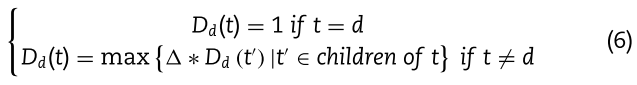
其中语义贡献因子(![]() =0.5)[37]。 这意味着随着疾病t与其祖先的距离越远,疾病t对疾病d的语义贡献越低。 之后,不同疾病
=0.5)[37]。 这意味着随着疾病t与其祖先的距离越远,疾病t对疾病d的语义贡献越低。 之后,不同疾病![]() 和
和![]() 之间的相似性可以评估如下:
之间的相似性可以评估如下:
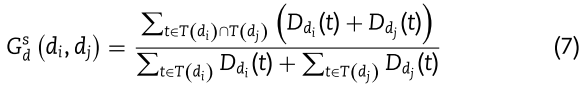
其中![]() 分别表示疾病 t 对疾病
分别表示疾病 t 对疾病![]() 的语义贡献。 矩阵
的语义贡献。 矩阵![]() 可以看作是疾病的语义视图,其中 N 表示疾病的个数。
可以看作是疾病的语义视图,其中 N 表示疾病的个数。
3.2.4.基于靶标的疾病相似度度量(Target-based similarity measure for diseases)
基于靶标的疾病相似性度量类似于计算miRNA功能相似性,使用疾病和基因之间的关联。 类似地,疾病![]() 的相似度公式可定义为:
的相似度公式可定义为:
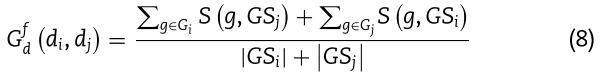
与miRNA功能相似性相似,![]() 分别代表与疾病
分别代表与疾病![]() 相关的基因集。 从而得到了疾病基于靶标的相似度视图
相关的基因集。 从而得到了疾病基于靶标的相似度视图![]() 。
。
3.3.多视图GCN编码器(Multiview GCN encoder)
GCN 是一种强大的图形神经网络,它直接作用于图上,利用图的结构信息。它可以聚合关于邻居的信息,捕获数据之间的依赖关系,并生成图中节点的有用表示。为了捕获多个相似视图的结构信息,我们使用GCN对不同的相似性视图分别进行编码。 如图1A所示,利用GCN在不同视图中获得miRNA和疾病的嵌入。 我们将miRNA的第 s 个视图和疾病的第 q 个视图分别定义为![]() 。 给定
。 给定![]() 作为miRNA
作为miRNA![]() 特征,在视图S中,特征
特征,在视图S中,特征![]() 分别属于它的邻居:
分别属于它的邻居:![]() 。 在学习嵌入时,除了邻居信息外,节点本身的信息也不能忽略。 对于从miRNA
。 在学习嵌入时,除了邻居信息外,节点本身的信息也不能忽略。 对于从miRNA ![]() 及其邻居传递的消息,我们可以得到
及其邻居传递的消息,我们可以得到![]() 在视图
在视图![]() 中的表示如下:
中的表示如下:
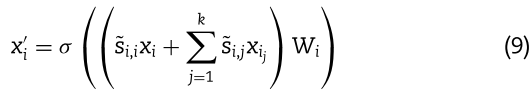
其中![]() 表示视图
表示视图![]() 中miRNA
中miRNA ![]() 与其邻居
与其邻居![]() 对应的归一化相似度权重;
对应的归一化相似度权重; ![]()
![]() 是将特征投射到潜在空间的可学习参数,σ(·)表示非线性激活函数。
是将特征投射到潜在空间的可学习参数,σ(·)表示非线性激活函数。
利用视图S上的GCN得到单个节点的传播规则后,我们可以得到整个图![]() 上的miRNA节点嵌入:
上的miRNA节点嵌入:
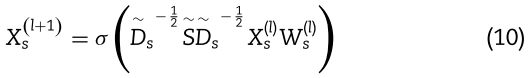
其中,![]() 表示视图
表示视图![]() 上
上![]() GCN层得到的
GCN层得到的![]() 个miRNA节点的
个miRNA节点的![]() 维嵌入,特别地,
维嵌入,特别地,![]() 是随机初始化的嵌入;
是随机初始化的嵌入; ![]() ∈
∈![]() 是一个可学习的矩阵,
是一个可学习的矩阵,![]() 表示对角矩阵,
表示对角矩阵,![]() 。
。 ![]() 是视图
是视图![]() 上对应的归一化相似度权重矩阵。 由于我们添加了一个 self-loop 来保证节点本身的重要性,因此公式构造如下:
上对应的归一化相似度权重矩阵。 由于我们添加了一个 self-loop 来保证节点本身的重要性,因此公式构造如下:
![]()
类似地,我们可以得到在![]() 视图
视图![]() 上的疾病节点嵌入:
上的疾病节点嵌入:
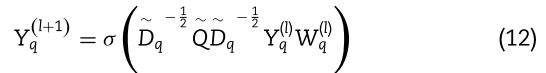
类似地,![]() 表示在视图
表示在视图![]() 上
上![]() GCN层得到的
GCN层得到的![]() 个疾病节点的
个疾病节点的![]() 维数嵌入,特别地,
维数嵌入,特别地,![]() 是一个随机初始化的嵌入;
是一个随机初始化的嵌入;![]() 是一个可学习的矩阵,
是一个可学习的矩阵,![]() 表示一个对角矩阵,
表示一个对角矩阵,![]()
![]() 。
。![]() 表示添加 self-loop 后视图
表示添加 self-loop 后视图![]() 上的相似度权重矩阵:
上的相似度权重矩阵:
![]()
对于单一视图中的miRNAs和疾病,我们可以得到它们的嵌入如下:
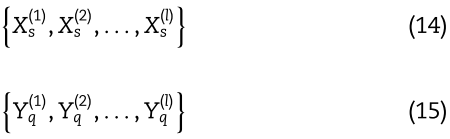
其中![]() 表示GCN的层数。
表示GCN的层数。
利用多层GCN对miRNAs和疾病的多视图进行编码,可以从不同角度获取miRNAs和疾病的特征。 对于S视图的miRNAs和Q视图的diseas,它们的特征可以表现为:
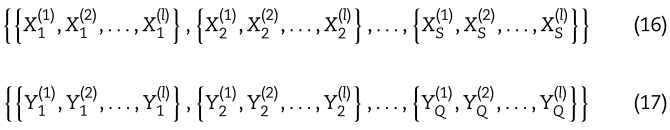
在得到不同视图下的多个嵌入后,下一步将介绍如何聚焦更重要的特征信息。
3.4.多通道注意力(Multichannel attention)
在社交网络的用户物品推荐任务中,用户的购买行为是由一个或多个动机驱动的,物品的特征往往包括多个方面。 对于推荐任务,单一的视角嵌入可能无法达到预期的效果。 因此,在此类任务中,研究者倾向于从多个视角获取用户和物品的嵌入,不同视角在学习其嵌入时应该有不同的贡献[38],同样的方式,对于miRNAs和疾病,从不同相似性视角中提取的节点特征可能包含截然不同的上下文信息,由此我们引入注意力机制来聚焦更重要的特征。
如图1B所示,将miRNA的多个特征矩阵堆叠形成一个特征张量,我们将堆叠的miRNA特征张量看作一幅图像,将miRNA的每个特征矩阵看作图像上的一个通道。 然后,从多个视图中提取特征重要性的任务可以转化为在图像特征提取中获取多个通道的重要性。 受到胡等人的启发[39],我们使用通道上的注意力来为特征分配权重。
为了获得不同通道的重要性,我们首先利用全局平均池化生成基于通道的统计信息。 对于含有![]() 通道的miRNAs,通过压缩miRNAs的特征
通道的miRNAs,通过压缩miRNAs的特征![]() ,
,![]()
![]() ,得到统计量
,得到统计量![]() 。 具体来说,对于miRNA 的
。 具体来说,对于miRNA 的![]() 特征矩阵
特征矩阵![]() ,通道统计量
,通道统计量![]() 计算为:
计算为:
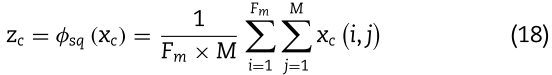
为了充分捕捉通道的重要性,我们采用注意力机制来计算通道的注意力权重:
![]()
其中![]() 为sigmoid激活,
为sigmoid激活,![]() 为Relu激活,
为Relu激活,![]() =
= ![]() 为训练参数。 最后,多通道注意力可以定义为
为训练参数。 最后,多通道注意力可以定义为![]() 。
。
得到不同通道的注意力权重后,我们将通道特征与注意力结合起来对其进行归一化,定义如下:
![]()
通过以上步骤,我们可以得到归一化的miRNA通道信息![]() 。 类似地,疾病的通道信息
。 类似地,疾病的通道信息![]() 。
。
接下来,我们将介绍如何结合通道信息来学习最终的miRNA和疾病嵌入。
3.5.CNN组合器(CNN combiner)
由于CNN的多重卷积核可以帮助我们学习节点特征中复杂的非线性关系,在获得miRNA的多通道特征后,利用CNN进行特征提取,生成融合多个视图信息的最终miRNA嵌入。 给定miRNA通道信息![]() ,最终嵌入
,最终嵌入![]()
![]() 定义如下:
定义如下:

其中![]() 表示卷积滤波器,它属于集合
表示卷积滤波器,它属于集合![]() ,
,![]() 表示卷积操作。
表示卷积操作。 ![]() 表示从
表示从![]() 个输出通道的嵌入,其中
个输出通道的嵌入,其中![]() 。 通过对多个输出通道的嵌入进行叠加,得到最终的miRNA嵌入
。 通过对多个输出通道的嵌入进行叠加,得到最终的miRNA嵌入![]() 。
。
类似地,我们可以得到疾病最终嵌入![]() ,这些学习到的嵌入将作为最终miRNA与疾病关联预测任务的输入。
,这些学习到的嵌入将作为最终miRNA与疾病关联预测任务的输入。
3.6.miRNA与疾病的关联预测(Association prediction for miRNA and disease)
我们把miRNA和疾病关联预测看作是一个推荐任务,偏好矩阵![]() 可以计算为:
可以计算为:
![]()
对于U中的元素,![]() 越高,miRNA
越高,miRNA![]() 与疾病
与疾病![]() 相关的可能性越大,反之,miRNA
相关的可能性越大,反之,miRNA![]() 与疾病
与疾病![]() 相关的可能性越小。
相关的可能性越小。
我们通过最小化偏好矩阵![]() 与标签矩阵
与标签矩阵![]() 之差的Frebious范数,利用均方误差作为模型的损失函数。 损失正式表述如下:
之差的Frebious范数,利用均方误差作为模型的损失函数。 损失正式表述如下:
![]()
我们在一台配有一个NVIDIA 2060 GPU和一个3.60GHz Intel(R)Core(TM)i7-9700K CPU和32 GB内存的机器上测试我们的代码,MMGCN在HMDDV3.2数据集上的运行时间为753 s。
4.实验(experiments)
4.1.数据准备(Data preparation)
我们使用多个生物医学数据集来提取miRNAs和疾病的多源信息,并为后续的关联预测任务构建多视图网络。 下面我们描述了在我们的研究中建立多视图网络的过程。
从 HMDDv3.2[40]获得已知的被文献中的实验证据证实的人类 miRNA-疾病关联,其中包括1206个 miRNA 和894个疾病之间的35547个关联。miRNA序列信息从miRBase Release 22[41]中下载,其中包含1917个人类miRNA。miRTarBase Release 8.0[42]包含502,652对miRNA基因关系,包括2599个miRNAs。 正如以前的研究[34,37]所做的那样,我们将多个miRNA转录本(transcript)根据相同的成熟miRNA合并。 然后我们将数据集相交,得到905个具有序列信息的疾病相关miRNAs。 从MESH(https://www.nlm.nih.gov/mesh/)和DisGeNET V7.0[43]中下载了疾病的语义树和疾病与基因关系。 两个数据库分别包含29 638种和30 170种疾病。 在合并重复项和去除不规范数据后,我们在853个miRNA和591个疾病中得到了12个446个实验验证的miRNA与疾病的关联。 由HumanNet V2[36]得到加权基因-基因关联网络。 对于上述获得的miRNAs和疾病,分别有14971和19258基因与它们相关。
此外,为了更好地评价模型的性能,我们使用miR2disease数据库[44]构建了一个小型多视图网络。 miR2disease包含了2925个实验证实的438个miRNAs与174种疾病之间的关联。 我们用和上面同样的方法对数据集进行交集和重复数据删除,最终得到701个miRNA-疾病关联,包括193个miRNA,54个疾病。
4.2.实验设置(Experiment settings)
我们通过五折交叉验证来评估MMGCN预测潜在疾病相关miRNAs的性能。 在每一轮中,已知的miRNA与疾病的关联被认为是阳性样本,并随机分为五个不相交的子集。 其中一个子集作为测试集,其余的子集作为训练集。 GCN层数取{2,3,4},miRNA和疾病的嵌入大小取{32,64,128,256},滤波器数取{32,64,128,256},学习速率取{0.1,0.01,0.001}。 我们在HMDD和MIR2疾病数据集上评估MMGCN和基线模型的性能,其他基线使用的参数在补充材料中。 MMGCN模型的分析实验是基于HMDD数据集的。 所有实验重复10次以获得对预测结果的合理估计。
评估指标包括接收机工作特性(ROC)曲线(AUC)、精确度/查全率(PR)曲线(AUPRC)、准确度、精确度、查全率和F1得分。 此外,通过基于计算模型获得的排名靠前的与疾病相关的miRNAs来指导湿实验是很重要的。 因此,我们使用 precision@N 和 recall@N 来验证MMGCN和其他方法在排名前N内的性能。我们在所有实验中设置 N ={5%,10%}。 报告的结果是10次运行的平均值。
4.3.基线(Baselines)
为了证明我们的方法的有效性,我们将其与以下基线进行了比较。 在本研究中,比较方法和MMGCN模型在同一数据集上运行。
IMCMDA[18]:该方法综合了miRNA功能相似度、疾病语义相似度和高斯相互作用图谱核相似度,并利用归纳矩阵补全来产生关联。
SPM [34] : Zeng等人通过整合 miRNA-疾病关联网络及其相似性网络构建双层网络,然后利用结构扰动方法发现 miRNA 与疾病之间的潜在关联。
MDHGI[45] : 它是一个矩阵分解和异构图推理的计算模型,用于发现新的miRNA与疾病的关联。
GRGMF[17] : 该方法利用相似信息作为Laplacian正则化项,提出了图正则化广义矩阵分解来识别生物医学二部网络中的潜在链接。
NIMCGCN[46] : Li等分别对miRNA相似度网络和疾病相似度网络进行了GCN分析,并引入神经归纳矩阵补全法预测miRNA与疾病的关联。
MDA-SKF[31] : 该方法提出了一种新的相似核融合方法,分别整合了多个miRNA和疾病相似核。 然后利用拉普拉斯正则化最小二乘法来发现潜在的miRNA与疾病的关联。
KBMFMDA[47] : 是一种结合了基于核的非线性降维、矩阵分解和二值分类的新型贝叶斯模型。 该方法将miRNAs和疾病投影到一个统一的子空间中,然后预测潜在的疾病miRNAs。
SNMDA[48] : 利用miRNA疾病关联网络的稀疏性,提出了一种基于稀疏邻域的预测潜在miroRNA疾病关联的新方法。
LLCMDA[49] : 它是一种基于局部约束线性编码(LLC)的方法。 该方法利用LLC重构miRNAs和疾病的相似度网络,然后在相似度网络上进行标记传播,得到可靠的相关分数,最终输出结果。
4.4.性能比较(Performance comparison)
在HMDD和miR2disease数据集上,我们使用10次5折交叉验证来评估MMGCN与其他基线的性能。
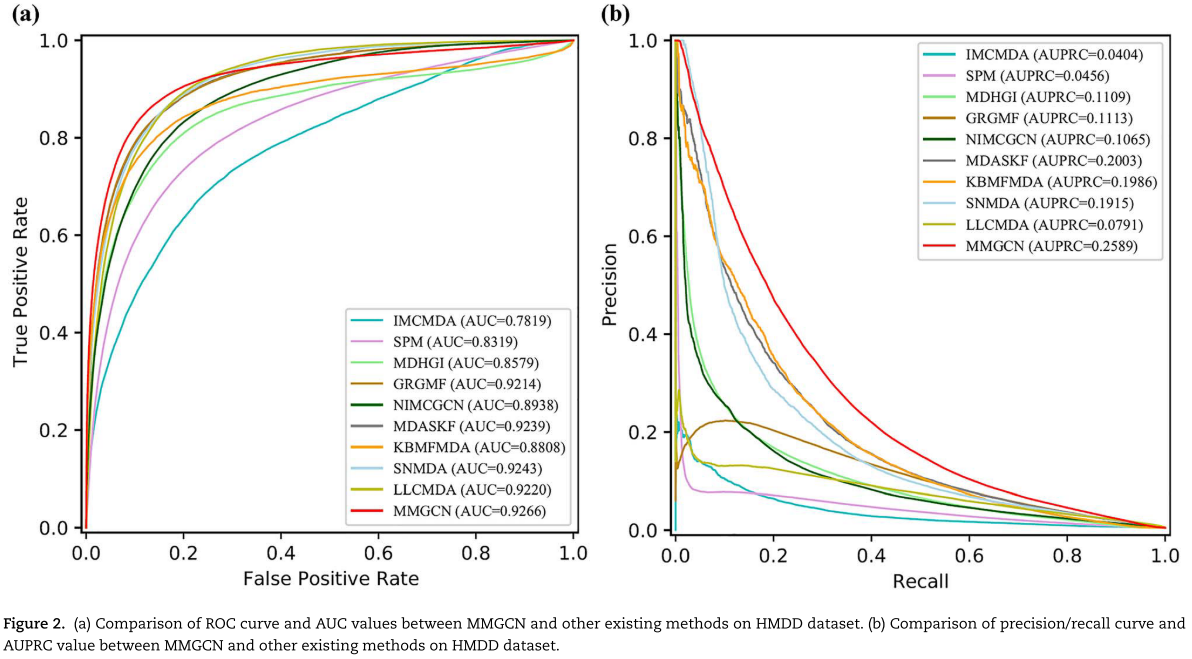
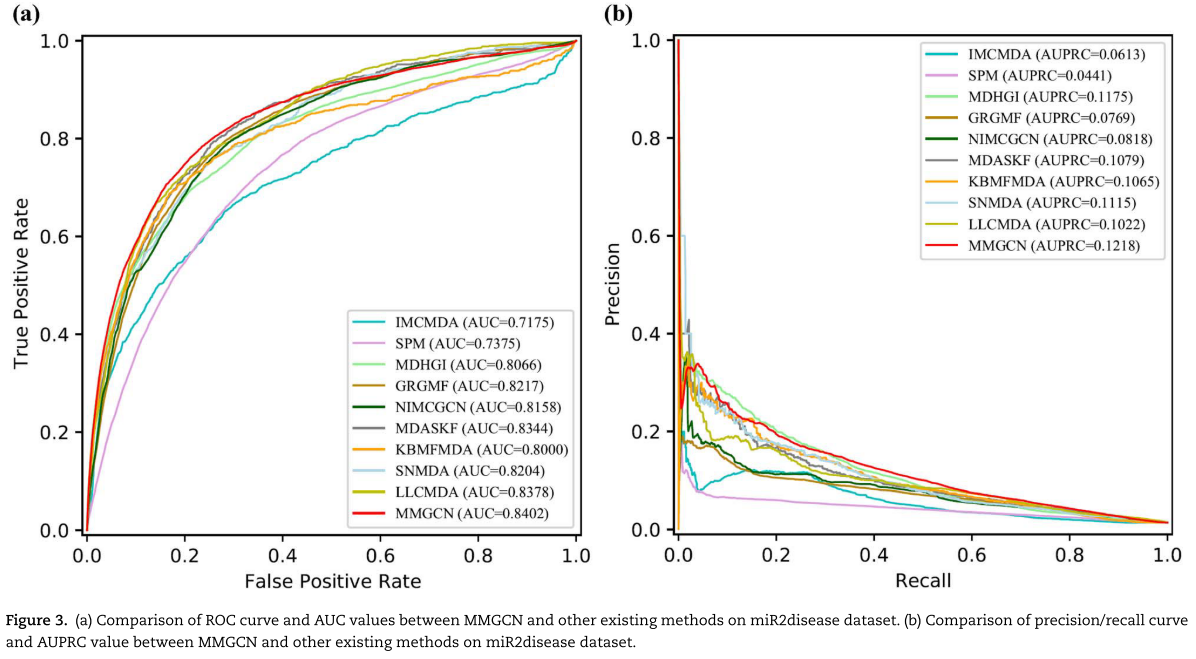
如图2和3以及表1和2所示,我们提出的MMGCN方法可以在这两个数据集上获得竞争性的性能。 对于HMDD数据集,MMGCN在所有评估指标下都优于所有其他方法。 由于数据的稀疏性,MMGCN的查准率和查全率都比较低。 但MMGCN仍然优于比较方法,这可能是由于多视角注意力机制的使用,即多通道注意力机制使MMGCN能够捕捉到更丰富、更重要的特征。 它论证了模型设计的合理性。 与单视图方法(GRGMF)相比,我们的MMGCN使用了多个相似的视图来使模型能够学习更多的信息。 与简单地将不同的相似视图合并为一的方法(IMCMDA、SPM、MDHGI、NIMCGCN、KBMFMDA、SNMDA和LLCMDA)相比,MMGCN通过精心设计的通道注意力机制自适应地学习不同视图特征的权重,从而聚焦于更重要的特征。 虽然MDASKF是一种多核融合方法,它利用miRNAs和疾病的三种相似信息进行关联预测,融合的信息比MMGCN多,但性能仍然不如MMGCN。 可能是因为MMGCN采用图神经网络捕捉节点的上下文信息,具有更好的表示能力。 对于 miR2disease 数据集,图3和表2显示 MMGCN 也可以在较小的数据集上表现良好。在大多数情况下,该方法优于其他比较方法。总的来说,这些实验结果表明了 MMGCN 在预测 miRNA 与疾病的潜在关系方面的有效性。


4.5.消融研究(Ablation study)
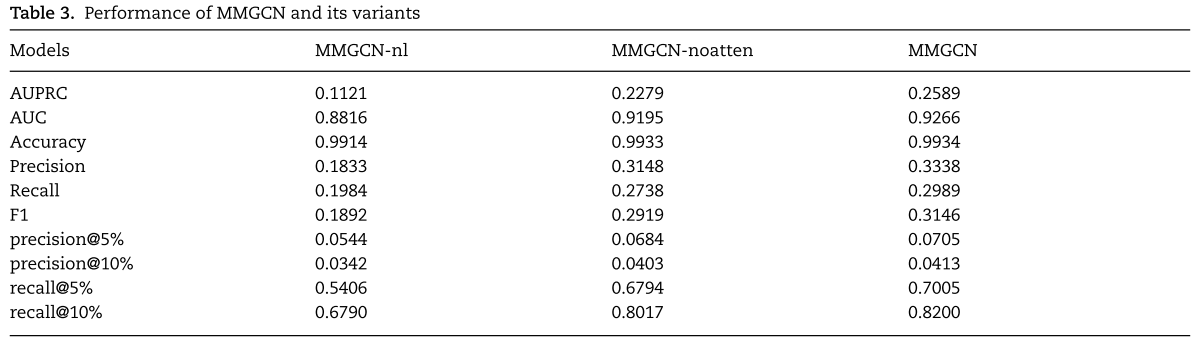
为了分析模型组件的必要性,我们采用了MMGCN的两个变体(MMGCN-nl和MMGCN-noatten)作为比较方法。 具体来说,MMGCN-nl意味着我们只使用GCN在第n层的输出作为特征。 MMGCN-noatten消除了多通道注意力,将不同通道信息视为同等重要的信息,仅使用CNN合并器进行特征融合。
表3显示了 MMGCN 及其变体模型获得的平均评估指标。对于 MMGCN-nl 和 MMGCN,在结合 GCN 的每一层的特征输出之后,与单层信息相比,该模型获得了更多的疾病和 miRNA 结构特征。结果表明,网络中不同距离的邻居可能包含不同的信息。对于 MMGCN-noatten 和 MMGCN,在不同特征上加入适应性注意机制后,与简单组合相比,MMGCN 可以获得更好的 miRNA 和疾病的最终嵌入。实验结果证明了特征信息在不同视图中的重要性是不同的。 使用多通道注意力机制可以增强节点的表示,从而提高预测性能。
4.6.不同视图融合的性能 (Performance of different view fusion)
为了证明多视图学习的有效性,我们比较了利用不同视图的方法的结果。
如表4所示,MMGCN使用miRNA和疾病相似度网络的所有视图能达到最佳性能。 此外,在miRNA相似度视图一致的情况下,在疾病相似度网络上添加更多的视图会比只添加单个视图的方法有更好的性能,反之亦然。 一个可能的原因是不同视图信息的加入丰富了节点的特性。 但是,模型也可能存在多添加一个视图而导致性能下降的问题。 以miRNA功能相似度![]() 和疾病语义相似度
和疾病语义相似度![]() 为例,MMGCN的准确率为0.9932,而加入疾病基于靶标相似度
为例,MMGCN的准确率为0.9932,而加入疾病基于靶标相似度![]() 后,准确率略有下降(0.9931)。 这可能是因为添加视图时的混合噪音造成的。但是在大多数情况下,增加多个视图可以有效地提高模型的性能。
后,准确率略有下降(0.9931)。 这可能是因为添加视图时的混合噪音造成的。但是在大多数情况下,增加多个视图可以有效地提高模型的性能。

综上所述,添加多个视图使MMGCN更加高效,特别是当所有视图都添加到模型中时,可以达到最佳性能。
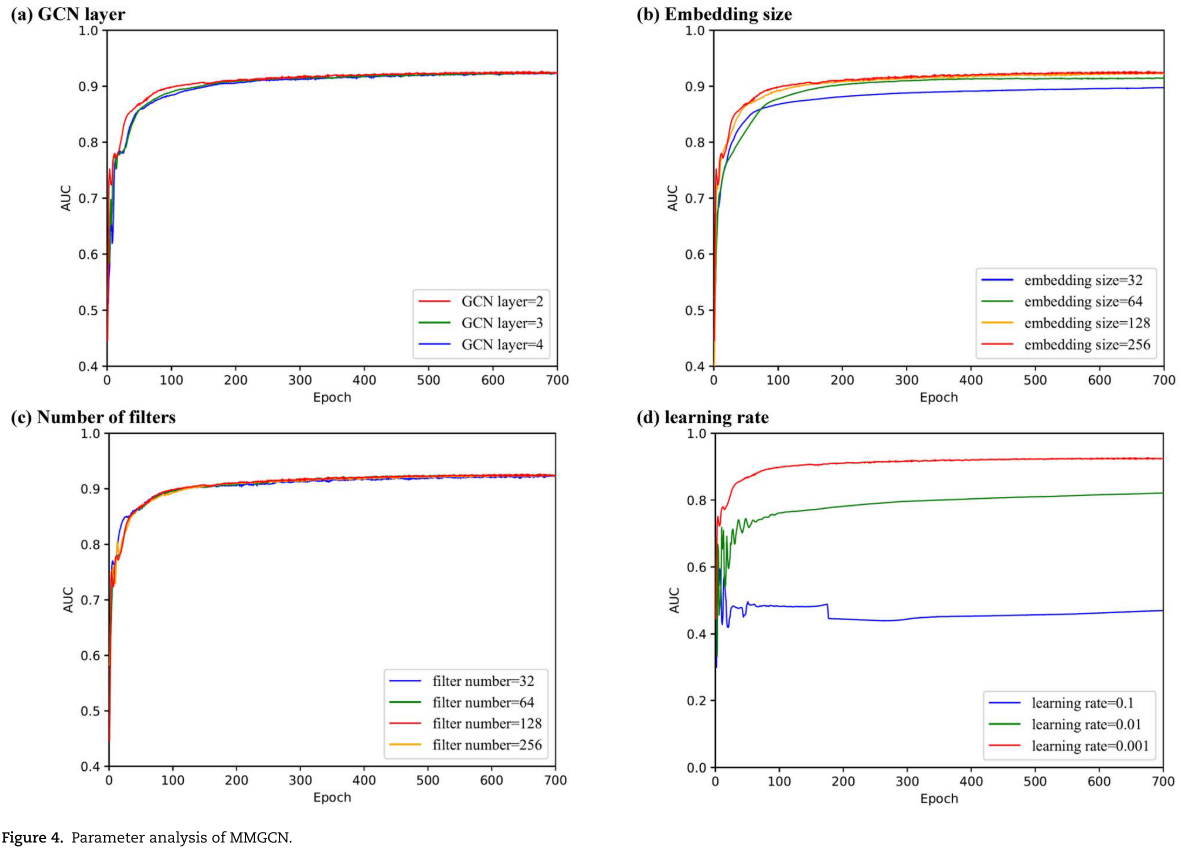
4.7.MMGCN的参数分析(Parameter analysis of MMGCN)
在本节中,我们将分析模型中的一些参数,以说明它们的影响。 所有实验基于已知miRNA与疾病关联重复10次5折交叉验证,以获得更准确的结果 。在以下内容中, 我们改变一个参数来测试它的效果,而其他参数是固定的。
4.7.1.GCN layer
我们利用GCN从不同角度获取miRNA和疾病的特征。 图4(a)表明GCN层数对模型性能的影响很小,这可能归因于多通道注意力模块。 GCN层的加深会使节点失去特征的多样性,但多通道注意力可以使模型集中于更重要的特征,减少无用特征的影响。 本文将GCN层数设为2。
4.7.2.嵌入尺寸(Embedding size)
GCN中节点的嵌入大小是MMGCN的一个重要因素,它可以直接影响模型的性能。 在此比较中,我们更改了嵌入大小在{32,64,128,256}。 从图4(b)可以看出,在一定范围内,嵌入维数越大,AUC值越高。 此外,模型在不同嵌入维数下的收敛速度是相似的,这可以证明我们的模型具有良好的稳定性。 本文将嵌入大小设置为256。
4.7.3.过滤器数量(Number of filters)
CNN中滤波器的数目决定了miRNA和疾病节点的最终特征维数。 在计算出最终特征后,模型将进行后续的矩阵补全任务。 从图4(c)可以看出,不同滤波器数目的模型在结果上波动很小,不影响模型的收敛速度。 本文将滤波器的个数设为128。
4.7.4.学习率
学习速率是控制梯度下降步长的参数,其取值关系到算法能否获得最优解。 较大的学习速率会导致模型不稳定,无法收敛。 反之,较小的学习速率可能使其容易陷入较差的局部极小值,收敛较慢。 图4(d)表明初始学习速率存在一个最优值,因此在本文中,我们将学习速率设置为0.001。
4.8.案例研究(Case studies)
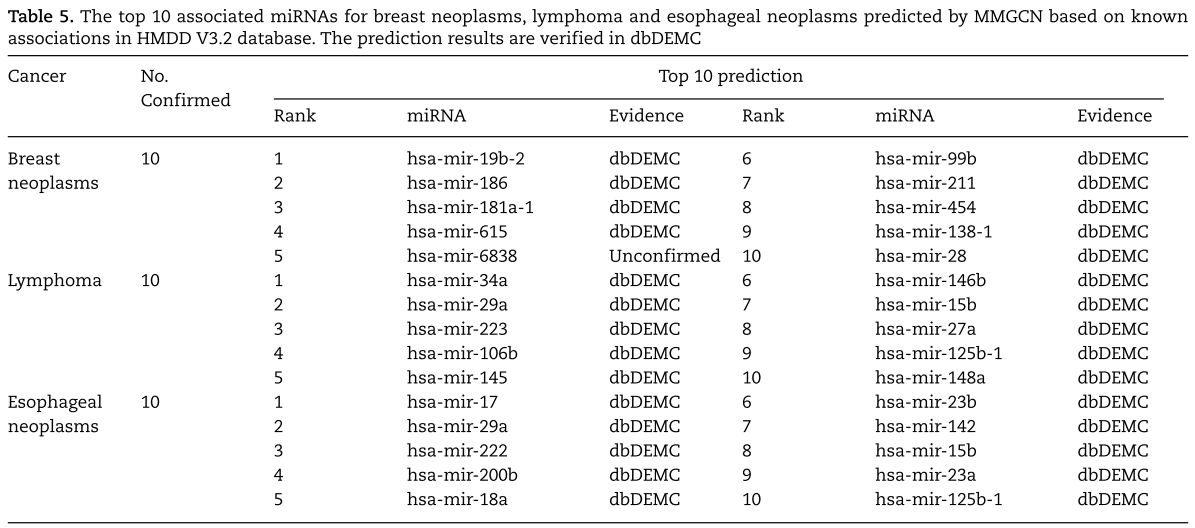
在这一节中,我们进行了两个案例研究,以证明我们的MMGCN在预测疾病与miRNAs之间的新关联方面的有效性和对新疾病的适用性。
在第一个案例研究中,我们专注于用我们的方法预测潜在的miRNA与疾病的联系。 特别地,我们使用MMGCN带有HMDD V3.2中所有已知的miRNA与疾病的关联作为训练数据集进行预测。 我们选择了三种疾病,即乳腺肿瘤、淋巴瘤和食管癌,对于每种疾病,我们根据预测的关联分数优先考虑前10个候选miRNAs。 如表5所示,我们列出了与上述三种疾病相关的前10个预测miRNAs,几乎都得到了独立外部数据库dbDEMC的证实[50]。
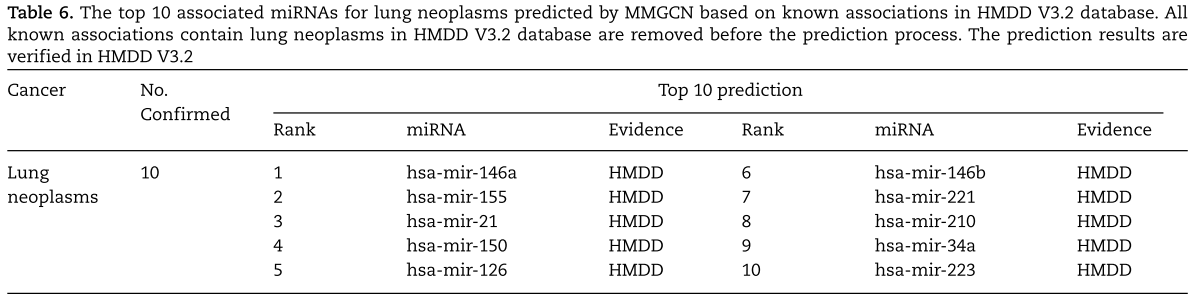
此外,为了说明MMGCN对新疾病的适用性,即没有已知相关miRNAs的疾病,我们进行了肺肿瘤的第二个病例研究。 HMDDV3.2与肺部肿瘤的已知关联全部从HMDDV3.2中删除,因此它可以被视为一种新的疾病。 在实施MMGCN并根据其关联评分对肺肿瘤候选miRNAs进行排序后,HMDD V3.2证实了前10个预测的肺肿瘤相关miRNAs中的10个(见表6)。
以上两个案例研究的结果表明,MMGCN可以获得优异的预测性能。 它不仅可以发现新的关联,而且在预测与新疾病相关的miRNAs方面也是可靠的。
5.结论(Conclusion)
在这项研究中,我们提出了一种新的基于多视图的图神经网络方法MMGCN,用于预测miRNA与疾病网络中的潜在关联。 MMGCN不仅能有效地利用已知关联预测潜在关联,还能自适应地从多个相似视图中提取有用信息,提高预测性能。 在两个数据集上的实验结果表明,MMGCN在大多数情况下都优于现有模型在5折交叉验证下。 并通过实验验证了模型各模块的有效性。 案例研究也验证了MMGCN在发现疾病与miRNAs之间新关联的能力及其对新疾病的适用性。
然而,还有一些工作需要进一步的研究。首先,不同视图融合实验表明,miRNA 与疾病之间相似网络的结构信息显著影响学习特征的表示,进一步影响最终的预测结果。如何收集各种有价值的生物信息,建立更有效的 miRNA 和疾病相似网络,是一个值得研究的课题。其次,需要进一步研究如何更合理地整合不同的生物信息,提高预测性能。
6.数据可用性 (Data availability)
Our work can be download in GitHub - Txinru/MMGCN: MMGCN:Multi-view Multichannel Attention Graph Convolutional Network for miRNA-disease Association Prediction
7.补充数据 (Supplementary data)
Supplementary data are available online at https://academic.oup.com/bib

