小罗碎碎念
这篇文章于2024-10-21发表在《Nature Reviews Cancer》,是一篇关于早期癌症研究的综述文章,标题为《Emerging strategies to investigate the biology of early cancer》。

| 作者角色 | 姓名 | 单位名称(中文) |
|---|---|---|
| 第一作者 | Ran Zhou | 四川大学华西医院 |
| 通讯作者 | Yuan Wang | 四川大学华西医院 |
文章介绍了几种用于研究早期癌症发展的临床样本和模型系统,包括自发性小鼠模型和类器官或干细胞衍生模型,并展示了增强我们对癌症启动和早期进展理解的新兴技术和计算工具,包括直接成像、谱系追踪、单细胞和空间多组学以及人工智能模型。这些模型和技术有助于更全面地理解早期恶性转化过程,揭示癌症发展的关键驱动因素和早期生物标志物。
文章还讨论了如何将这些新见解转化为基于机制的早期癌症检测和预防策略。具体来说,文章分为以下几个部分:
- 引言:强调早期癌症研究的重要性和挑战。
- 通过临床样本了解早期癌症:讨论了不同类型的癌症早期或癌前病变的样本,以及如何利用这些样本研究早期癌症。
- 自发性小鼠模型研究早期癌症:介绍了如何利用基因工程小鼠模型(GEMMs)和化学诱导模型来研究癌症的早期阶段。
- 类器官和干细胞衍生模型:讨论了如何利用这些模型来研究癌症的早期发展。
- 精准早期癌症检测和预防:探讨了如何将新见解转化为早期癌症检测和预防策略。
- 结论:总结了文章的主要观点。
文章强调了早期癌症研究的复杂性,并提出了一些新的研究方法和技术,这些方法和技术有望提高我们对早期癌症的理解,并最终导致更有效的检测和预防策略的开发。
一、正常细胞的多阶段恶性转化级联
1-1:三个阶段
这张图展示了正常组织向恶性组织转变的过程,分为三个主要阶段:正常组织、癌前组织和恶性组织。
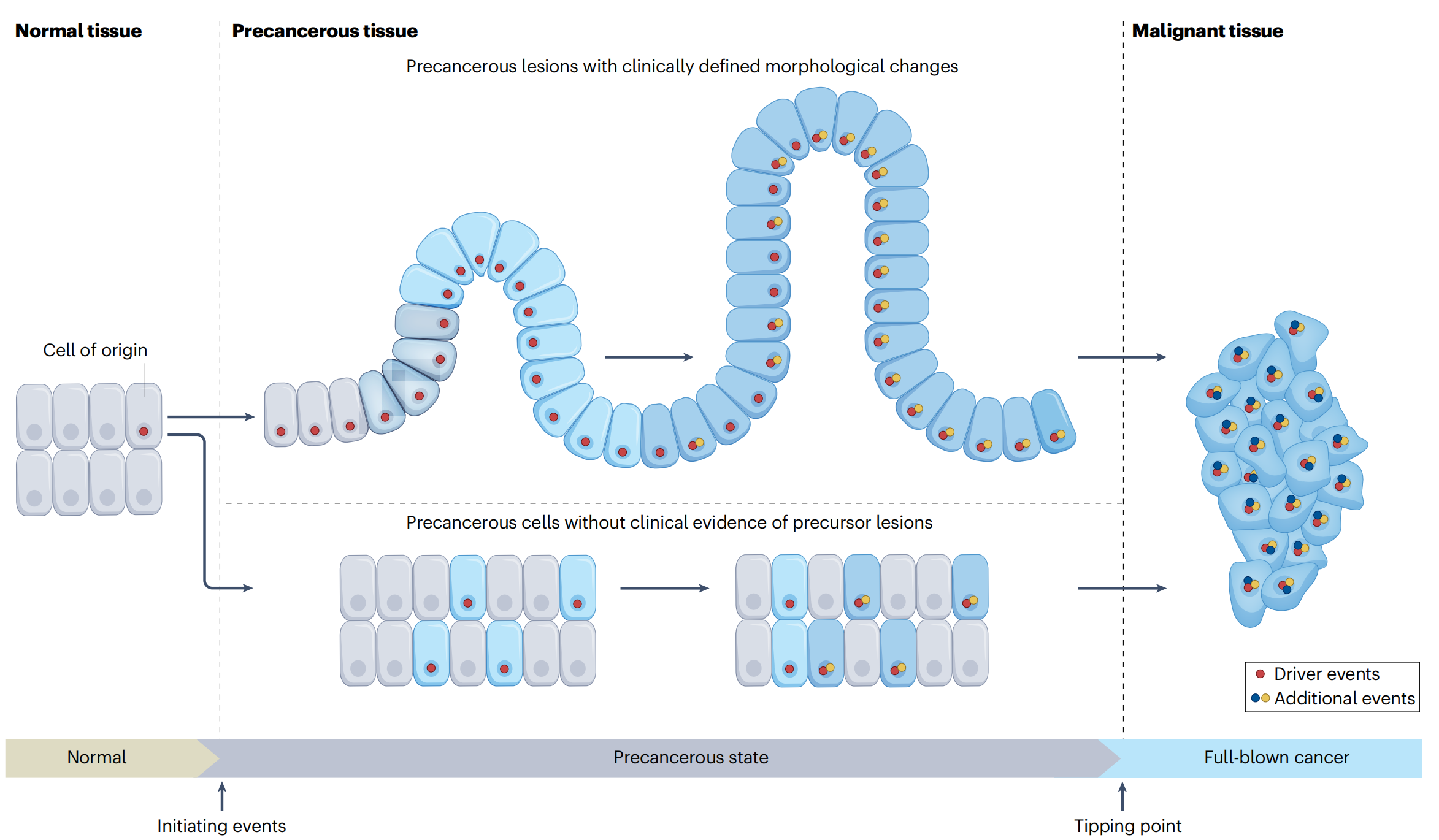
每个阶段都伴随着细胞的形态变化和基因事件的积累。
-
正常组织(Normal tissue):
- 细胞排列整齐,形态正常。
- 细胞中有一些基因突变(红色点),但这些突变尚未导致明显的形态变化。
-
癌前组织(Precancerous tissue):
- 细胞开始出现形态上的改变,但这些变化尚未达到临床诊断为癌前病变的程度。
- 细胞中积累了更多的基因突变(红色和黄色点),这些突变被称为“驱动事件”(driver events),是癌变的关键因素。
- 除了驱动事件外,还有一些“附加事件”(additional events),这些可能是次要的突变,但也对癌变过程有贡献。
-
恶性组织(Malignant tissue):
- 细胞形态发生显著变化,组织结构紊乱,这是癌症的典型特征。
- 细胞中积累了大量的基因突变,这些突变的累积最终导致了癌症的形成。
- 图中显示了从癌前状态到癌症的“临界点”(Tipping point),这是癌变过程中的一个重要转折点。
图中还提到了“起始事件”(Initiating events),这是指导致细胞开始癌变的最初基因突变。这些突变可能是由于环境因素、遗传因素或随机事件引起的。
1-2:癌前病变到癌症的分子和细胞变化过程
这张图展示了食管(Oesophagus)和结肠(Colon)中从癌前病变到癌症的分子和细胞变化过程。
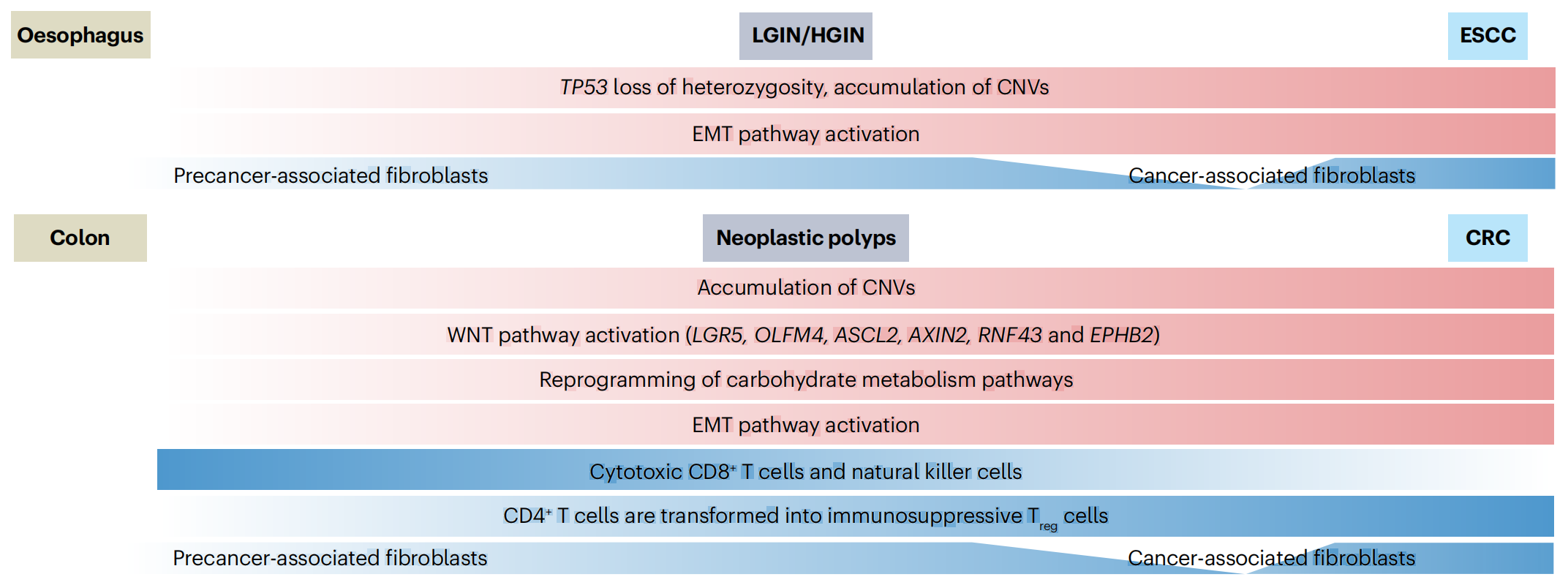
图中涉及的关键概念包括:
-
癌前病变(Precancerous lesions):
- 食管:LGIN(低级别上皮内瘤变)/HGIN(高级别上皮内瘤变)
- 结肠:新生物性息肉(Neoplastic polyps)
-
分子和细胞变化:
- 食管:
- TP53基因的杂合性丧失(loss of heterozygosity)和拷贝数变异(CNVs)的积累。
- 上皮-间质转化(EMT)途径的激活。
- 结肠:
- 拷贝数变异(CNVs)的积累。
- WNT途径的激活(涉及LGR5, OLFM4, ASCL2, AXIN2, RNF43和EPHB2等基因)。
- 碳水化合物代谢途径的重编程。
- EMT途径的激活。
- 食管:
-
免疫细胞的变化:
- 食管:没有特别提到免疫细胞的变化。
- 结肠:
- 细胞毒性CD8+ T细胞和自然杀伤细胞(NK cells)的存在。
- CD4+ T细胞转变为免疫抑制性调节性T细胞(Treg cells)。
-
成纤维细胞的变化:
- 食管:从癌前相关成纤维细胞(Precancer-associated fibroblasts)转变为癌症相关成纤维细胞(Cancer-associated fibroblasts)。
- 结肠:同样从癌前相关成纤维细胞转变为癌症相关成纤维细胞。
-
癌症类型:
- 食管:食管鳞状细胞癌(ESCC)
- 结肠:结直肠癌(CRC)
这张图强调了从正常组织到癌前病变再到癌症的转变过程中,分子事件、细胞途径激活、免疫细胞和成纤维细胞的变化是如何相互作用的。这些变化为癌症的发展提供了分子基础,并可能成为未来治疗的潜在靶点。了解这些过程有助于开发新的癌症预防和治疗策略。
二、来自各种组织的癌症前体病变的选定示例
-
肛管和肛周皮肤:
- 前癌性病变:异型增生(Dysplasia)
- 癌症类型:肛管癌(Anal cancer)
-
乳腺:
- 前癌性病变:非典型增生(Atypical hyperplasia);导管原位癌(ductal carcinoma in situ)
- 癌症类型:乳腺癌(Breast cancer)
-
宫颈:
- 前癌性病变:上皮内瘤变(Intraepithelial neoplasia)
- 癌症类型:宫颈癌(Cervical cancer)
-
结肠:
- 前癌性病变:腺瘤(Adenomas);锯齿状息肉(serrated polyps)
- 癌症类型:结直肠癌(Colorectal cancer)
-
子宫内膜:
- 前癌性病变:非典型增生(Atypical hyperplasia)
- 癌症类型:子宫内膜癌(Endometrial cancer)
-
食管:
- 前癌性病变:低级别上皮内瘤变(Low-grade intraepithelial neoplasia);高级别上皮内瘤变(high-grade intraepithelial neoplasia)
- 癌症类型:食管鳞状细胞癌(Oesophageal squamous cell carcinoma)
-
食管胃结合部:
- 前癌性病变:巴雷特食管(Barrett’s oesophagus)
- 癌症类型:食管腺癌(Oesophageal adenocarcinoma)
-
肺:
- 前癌性病变:非典型腺瘤样增生(Atypical adenomatous hyperplasia);腺瘤(adenoma)
- 癌症类型:肺腺癌(Lung adenocarcinoma)
-
胰腺:
- 前癌性病变:腺泡-导管化生(Acinar-ductal metaplasia);胰腺上皮内瘤变(pancreatic intraepithelial neoplasia)
- 癌症类型:胰腺导管腺癌(Pancreatic ductal adenocarcinoma)
-
骨髓:
- 前癌性病变:意义未明的单克隆丙种球蛋白病(Monoclonal gammopathy of undetermined significance);慢性多发性骨髓瘤(smouldering multiple myeloma)
- 癌症类型:多发性骨髓瘤(Multiple myeloma)
-
前列腺:
- 前癌性病变:上皮内瘤变(Intraepithelial neoplasia)
- 癌症类型:前列腺癌(Prostate cancer)
-
皮肤:
- 前癌性病变:日光角化病(Actinic keratosis)
- 癌症类型:鳞状细胞癌(Squamous cell carcinoma)
-
口腔组织:
- 前癌性病变:白斑(Leukoplakia)
- 癌症类型:头颈癌(Head and neck cancer)
三、人工智能模型预测癌症进展
即使在缺乏癌前病变的情况下,临床样本数据的不断增长也能为训练人工智能(AI)模型以预测早期癌症提供丰富的资源68,69。
利用深度学习或机器学习算法,或大型语言模型70的AI模型,通过整合包括放射学、影像学、组织学、多组学数据和电子健康记录在内的广泛多模态数据,促进了早期癌症研究,特别是在早期癌症的检测和诊断方面,以识别这些不同数据类型内和跨数据类型的预测特征71。
癌前病变可以通过医学成像技术直接成像,包括CT、MRI、PET-CT和内窥镜72,基于图像的AI模型已开发用于检测乳腺、肺、食管、宫颈和胰腺的早期癌症,并已进入临床实践69,73–78。
结合患者的临床结果信息,AI模型还能预测癌前病变发展成癌症的可能性。例如,一种名为CancerRiskNet的机器学习模型,通过训练患者的临床病史,包括急性胰腺炎和其他胰腺疾病的诊断,以及体重减轻和2型糖尿病等额外风险因素,建立用于预测胰腺癌风险的模型79。
一些AI模型在识别癌症方面的有效性已经通过临床试验得到验证,例如在一个随机临床试验中,表明用于补充MRI的AI模型在早期乳腺癌检测的效率是传统乳腺密度测量的四倍81。
AI模型越来越多地应用于整合多组学临床数据集,以提高风险预测和模式识别的准确性。例如,利用机器学习遗传和代谢数据,从血浆样本中无创性地识别胃癌的代谢特征82。同样,DeepTrace结合了无端修复酶甲基化测序的细胞游离DNA和预训练的神经网络,用于早期检测肝细胞癌83。
AI模型还能推断在没有已知癌前阶段或样本的癌症中的早期遗传改变的序列。例如,PhylogicNDT可以分析晚期头颈部鳞状细胞癌的基因组测序数据,使用全基因组扩增作为里程碑事件和已知的突变率来重建癌症突变历史68。这种算法可能被应用于其他同样缺乏早期阶段样本的癌症类型。