【医学影像 AI】使用非成像机器学习方法预测 ROP 的研究
0. 论文简介
0.1 基本信息
2025年,日本 Yamagata University Faculty of Medicine 的 Yusuke Takeda 等 在 Lancet Digit Health 发表论文 “使用非成像机器学习方法预测早产儿视网膜病变:一项区域多中心研究(Prediction models for retinopathy of prematurity using non-imaging machine-learning approaches: A regional multicenter study)”。
本研究展示了非成像机器学习模型在预测ROP发生方面的潜力,特别是在资源有限或无法使用眼底相机的环境中。通过使用表格数据(如孕周、出生体重等),研究提供了一种低成本、高效的ROP预测方法,具有较高的预测能力和稳定性。
论文下载: ophthalmologyscience
引用格式:
Takeda, Yusuke et al., Prediction models for retinopathy of prematurity using non-imaging machine-learning approaches: A regional multicenter study, Ophthalmology Science, Volume 0, Issue 0, 100715
0.2 摘要
-
目的
利用首次筛查时的临床数据,开发非成像的机器学习模型,以预测早产儿视网膜病变(ROP)的发生。 -
设计
这项多中心区域研究在日本山形县进行。 -
受试者、参与者及对照组
我们收集了2016年10月至2018年9月期间出生并在四个新生儿护理单位接受筛查的新生儿的临床数据。 -
方法、干预或测试
首次筛查时可用的35个变量被用作可能的预测因子,用于开发决策树、随机森林、梯度提升树、神经网络和朴素贝叶斯模型。参数调优通过10折交叉验证进行。该过程使用不同的随机种子进行数据分割,重复200次。 -
主要结果指标
目标结果是最终的ROP结局,即在住院期间发展为任何阶段的ROP。 -
结果
在215名接受筛查的新生儿中,43名(20.0%)发展为ROP。中位(四分位距[IQR])孕周为31.4(28.1–33.4)周,中位(IQR)出生体重为1502(967–1823)克。随机森林模型的200次迭代的平均AUC-ROC、准确率、灵敏度和特异性分别为0.93(95% CI 0.83–0.99)、90.1%(95% CI 84.1–95.2)、95.7%(95% CI 88.2–100)和66.0%(95% CI 41.7–91.7)。朴素贝叶斯模型的200次迭代的平均AUC-ROC、准确率、灵敏度和特异性分别为0.94(95% CI 0.86–0.99)、90.6%(95% CI 84.1–96.8)、94.6%(95% CI 86.3–100)和73.6%(95% CI 50.0–91.7)。 -
结论
非成像机器学习方法在预测ROP发生方面表现出高性能。这些模型在眼底相机因眼部混浊无法捕捉图像时以及缺乏儿科眼底相机的医院中非常有益。 -
关键词
早产儿视网膜病变(ROP),机器学习,非成像,多中心研究
0.3 研究背景
1. 引言
早产儿视网膜病变(Retinopathy of Prematurity, ROP)是儿童失明的主要原因,全球发病率呈上升趋势[1-3]。随着围产医学的进步,许多原本无法存活的新生儿得以挽救,从而在整体上降低了ROP的发病风险[3,4]。在实际操作中,眼底检查通常基于筛查标准(主要是孕周和出生体重)启动。为了达到最佳诊断和治疗效果,需要多次进行眼底检查,但这会给新生儿带来身体负担。
尽管有许多研究关注预测ROP进展为严重病变或需要治疗的ROP的模型[5-9],但关于ROP发生的预测模型的研究较少。关于ROP的发生,基于评分和逻辑回归的模型使用临床状态数据表现出中等的预测性能[10-13]。使用眼底图像的深度学习模型显示出良好的预测能力[14];然而,极早产儿可能无法拍摄眼底照片,且一些医院无法负担儿科眼底相机。尽管有多种模型,但关于ROP发生预测的研究仍存在空白。据我们所知,目前尚未有仅使用表格数据的机器学习模型的发表。这些数据包括人口统计和临床信息,比使用儿科眼底相机获取的影像数据更容易获得,尤其是在资源匮乏的地区。
本研究旨在利用首次筛查时的非成像机器学习方法开发ROP发生的预测模型。这些预测模型在无法使用眼底相机数据的情况下(如因眼部问题无法拍摄照片的新生儿或没有儿科眼底相机的医院)可能非常有益。
2. 方法
2.1 研究设计与人群
这是一项在日本山形县进行的区域多中心研究。
研究收集了2016年10月至2018年9月期间出生并在该地区所有四个新生儿重症监护室(NICU)接受筛查的新生儿的临床数据(包括山形大学医院、山形县立中央医院、山形济生医院和鹤冈市庄内医院)。
数据是前瞻性收集的,用于描述流行病学、风险分析和预测模型的研究。本研究回顾性分析了这些数据,以利用机器学习方法开发预测模型。研究获得了患者父母或监护人的书面知情同意。新生儿的筛查依据日本标准:出生体重≤1800克、孕周≤34周,或超过这些阈值但仍存在风险的新生儿[15]。眼底检查在孕周31周时开始(对于孕周小于28周的新生儿)或在出生后4周时开始(对于孕周≥28周的新生儿)[16]。
诊断依据《国际ROP分类修订版》[17],治疗则根据《ROP早期治疗研究报告》[18]进行。眼底检查使用双目间接检眼镜和20或28屈光度镜头。所有眼底检查和治疗均由日本眼科学会认证的眼科医生完成。研究收集了ROP最终结局、孕周、出生体重以及其他与治疗和合并症相关的新生儿因素的数据。此外,还使用了新生儿医疗记录中描述的母体及其他相关因素。
本研究获得了山形大学医学院伦理审查委员会的批准(编号:2016-244),并遵循《赫尔辛基宣言》的原则。
2.2 目标结局与预测变量
目标结局是ROP的最终结局,即新生儿在住院期间是否发展为ROP。针对ROP的每个阶段会导致较低的发生率,因此使用任何阶段的ROP来构建稳健的预测模型。我们将任何阶段的ROP归类为“任何ROP”,而未发生ROP的归类为“无ROP”。
首次筛查时可用的35个变量被用作可能的预测变量:孕周、出生体重、首次筛查时的体重、宫内发育迟缓、女性性别、1分钟Apgar评分、5分钟Apgar评分、气管插管、表面活性剂使用、呼吸窘迫综合征、新生儿短暂性呼吸急促、咖啡因使用、慢性肺病、脑积水、脑室周围白质软化、脑室内出血、败血症、坏死性小肠结肠炎、动脉导管未闭、使用吲哚美辛治疗的动脉导管未闭、手术治疗的动脉导管未闭、促红细胞生成素使用、输血、母乳喂养(新生儿因素);母亲年龄、胎盘早剥、胎膜早破、前置胎盘、妊娠期糖尿病、孕前糖尿病、妊娠期高血压、绒毛膜羊膜炎、分娩时类固醇使用(母体因素);以及多胎妊娠和剖宫产(其他因素)。
在这些变量中,孕周、出生体重、首次筛查时的体重、1分钟Apgar评分、5分钟Apgar评分和母亲年龄被视为连续变量,其余变量为分类变量。
在数据分割前,删除了所有新生儿值相同的分类变量(例如,所有新生儿均为零值的变量),因为这些变量对模型性能没有贡献。此外,如果这些变量在初始筛查时未发生,则无需考虑对其他变量的偏差。
剩余的变量用于机器学习过程。研究使用测试集评估模型的有效性,并在模型选择过程中采用 10折交叉验证和200次迭代的机器学习方法以减少过拟合和偏差。
创新点:与以往研究不同,本研究专注于ROP的发生预测,而非其进展或治疗需求。此外,研究仅使用表格数据(非影像数据),这为资源匮乏地区提供了更可行的筛查工具。
2.3 数据分析与预测方法
研究使用 R软件(v4.3.1)进行数据分析,并利用以下R包开发模型:caret(v6.0.94)[19]、rpart(v4.1.19)[20]、randomForest(v4.7.1.1)[21]、xgboost(v1.7.5.1)[22]、nnet(v7.3.19)[23]、klaR(v1.7.2)[24]、pROC(v1.18.4)[25]、PRROC(v1.3.1)[26]、binom(v1.1-1.1)[27] 和 iml(v0.11.3)[28]。caret 包用于整合五个机器学习包:rpart 用于决策树,randomForest 用于随机森林,xgboost 用于梯度提升树,nnet 用于神经网络,klaR 用于朴素贝叶斯。
变量重要性计算
变量重要性通过caret包的varImp函数计算。然而,由于朴素贝叶斯模型假设各变量相互独立,因此无法计算其变量重要性。因此,变量重要性计算仅应用于其他四种模型。类似地,使用iml包计算了四种模型的SHAP(SHapley Additive exPlanations)值,朴素贝叶斯模型除外。
模型评估
使用caret包的confusionMatrix函数生成混淆矩阵。pROC包用于可视化受试者工作特征曲线(ROC曲线)并计算曲线下面积(AUC-ROC)。PRROC包用于生成精确率-召回率曲线(PR曲线)并计算曲线下面积(AUC-PR)。200次迭代的平均ROC和PR曲线通过非参数方法生成[29]。使用binom包计算单次拟合(非迭代)的灵敏度和特异性的置信区间(CI)。未指定的设置均采用caret包的默认配置。
算法概述
图1 展示了本研究中使用的算法概述。数据集通过R中的指定随机种子随机分为训练集(70%)和测试集(30%),并根据ROP概率进行划分。
研究使用了五种主要的机器学习方法:决策树[30]、随机森林[31]、梯度提升树[32]、神经网络[33]和朴素贝叶斯[34]。
 *图1:本研究中的模型开发和评估算法。 在参数调优和模型选择过程中使用了10折交叉验证,并通过200个不同的随机种子对数据划分过程重复进行了200次。缩写:AUC-ROC,受试者工作特征曲线下面积。*
数据预处理
在预处理步骤中,对连续变量进行了最小-最大归一化(Min-Max normalization)。参数调优通过在训练集上进行10折交叉验证完成,各包的调优参数如下:
- 决策树:cp
- 随机森林:mtry
- 梯度提升树:eta、max_depth、gamma、colsample_bytree、min_child_weight、subsample和nrounds
- 神经网络:size和decay
- 朴素贝叶斯:usekernel
模型选择与迭代
基于测试集的拟合准确率选择表现最佳的模型。为了减少仅使用一个随机种子进行数据划分带来的不确定性,研究使用R中的for循环函数,通过不同的随机种子重复数据划分和模型开发过程200次。
为了比较“任何ROP”组和“无ROP”组之间的背景因素(预测变量),分类变量采用卡方检验,连续变量采用Wilcoxon秩和检验。
2.4 结果指标
模型性能通过AUC-ROC(受试者工作特征曲线下面积)、准确率、灵敏度和特异性作为主要结果指标进行评估。研究分别计算了单次拟合(无迭代)和200次迭代平均值的主要结果指标。
3. 结果
3.1 统计摘要
在研究期间,共有215名新生儿接受了筛查,其中包括111名男性(51.6%)和104名女性(48.4%)。在首次筛查期间,没有新生儿被诊断为ROP。中位孕周(四分位距)为31.4(28.1–33.4)周,中位出生体重(四分位距)为1502(967–1823)克。在该队列中,43名新生儿(20.0%)发展为ROP。数据集中没有缺失值(表1)。
表1:ROP首次筛查的诊断和背景特征。数据以 n(%) 或其他方式表示。
缩写:ROP:早产儿视网膜病变;IQR:四分位数间距;PDA:动脉导管未闭;Apgar:appearance, pulse, grimace, activity, and respiration;NA:不可用。


3.2 数据预处理
如表1所示,有两个新生儿因素(分类变量)——慢性肺病和手术治疗的动脉导管未闭——在所有新生儿中均为零值。这两个变量在数据划分前被移除,剩余的33个变量被用作预测变量。
3.3 模型性能
3.3.1 单次迭代(无重复)的模型性能
表2 列出了单次迭代(无重复)的模型性能。
- 决策树模型的AUC-ROC为0.94,准确率为84.1%,灵敏度为93.6%,特异性为56.2%。
- 随机森林模型的AUC-ROC为0.97,准确率为92.1%,灵敏度为96.0%,特异性为76.9%。
- 梯度提升树模型的AUC-ROC为0.91,准确率为88.9%,灵敏度为95.8%,特异性为66.7%。
- 神经网络模型的AUC-ROC为0.88,准确率为87.3%,灵敏度为92.2%,特异性为66.7%。
- 朴素贝叶斯模型的AUC-ROC为0.97,准确率为93.7%,灵敏度为98.0%,特异性为78.6%。
表2。Sigle Fit模型性能
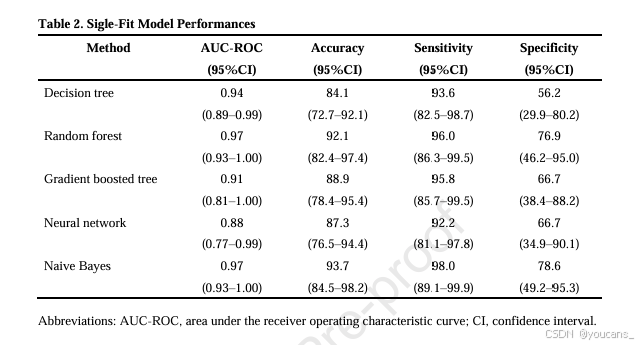
图2 展示了变量重要性;
图3 可视化了单次拟合(无迭代)的SHAP值;
图4 展示了混淆矩阵;
图5 展示了ROC曲线和PR曲线。

图2:四个模型的变量重要性(无200次迭代的单次拟合)。使用caret包的varImp函数计算单拟合变量重要性。PDA表示动脉导管未闭。
 *图3:四个模型的SHAP值(单次拟合,无200次迭代)。使用iml软件包计算单拟合SHAP(SHapley Additive exPlanations)值。PDA表示动脉导管未闭。*

图4:所有五个模型的混淆矩阵(无200次迭代的单次拟合)。使用caret包的confusion Matrix函数计算单拟合混淆矩阵。右下角的颜色条表示百分比刻度。

图5:所有五个模型的ROC和PR曲线(单次拟合,无200次迭代)使用pROC和PRROC软件包可视化单次拟合ROC曲线(A)和PR曲线。缩写:AUC-PR,精确召回曲线下面积;AUC-ROC,接收器工作特性曲线下的面积。
3.3.2 迭代200次的模型性能
表3 总结了200次迭代后的模型性能,包括平均AUC-ROC、准确率、灵敏度和特异性。除了主要结果指标外,还计算了阳性预测值(PPV)和阴性预测值(NPV):
- 决策树模型:阳性预测值为92.6%(95% CI 86.2–100),阴性预测值为69.8%(95% CI 47.0–100);
- 随机森林模型:阳性预测值为92.4%(95% CI 87.5–98.0),阴性预测值为79.9%(95% CI 58.3–100);
- 梯度提升树模型:阳性预测值为92.4%(95% CI 87.3–97.8),阴性预测值为71.1%(95% CI 52.6–91.9);
- 神经网络模型:阳性预测值为91.9%(95% CI 85.9–98.0),阴性预测值为73.4%(95% CI 50.0–100);
- 朴素贝叶斯模型:阳性预测值为93.9%(95% CI 88.7–98.0),阴性预测值为77.7%(95% CI 57.1–100)。

图6 展示了200次迭代后的变量重要性;
图7 可视化了200次迭代的SHAP值;
图8 展示了200次迭代的平均混淆矩阵;
图9 使用非参数方法展示了200次迭代的平均ROC曲线和PR曲线。

图6:四个模型的平均变量重要性(200次迭代)。使用caret包的varImp函数计算200次迭代的平均变量重要性。PDA表示动脉导管未闭。

图7:四个模型的平均SHAP值(200次迭代)使用iml包计算了200次迭代平均SHAP(SHapley Additive exPlanations)值。PDA是指动脉导管未闭。
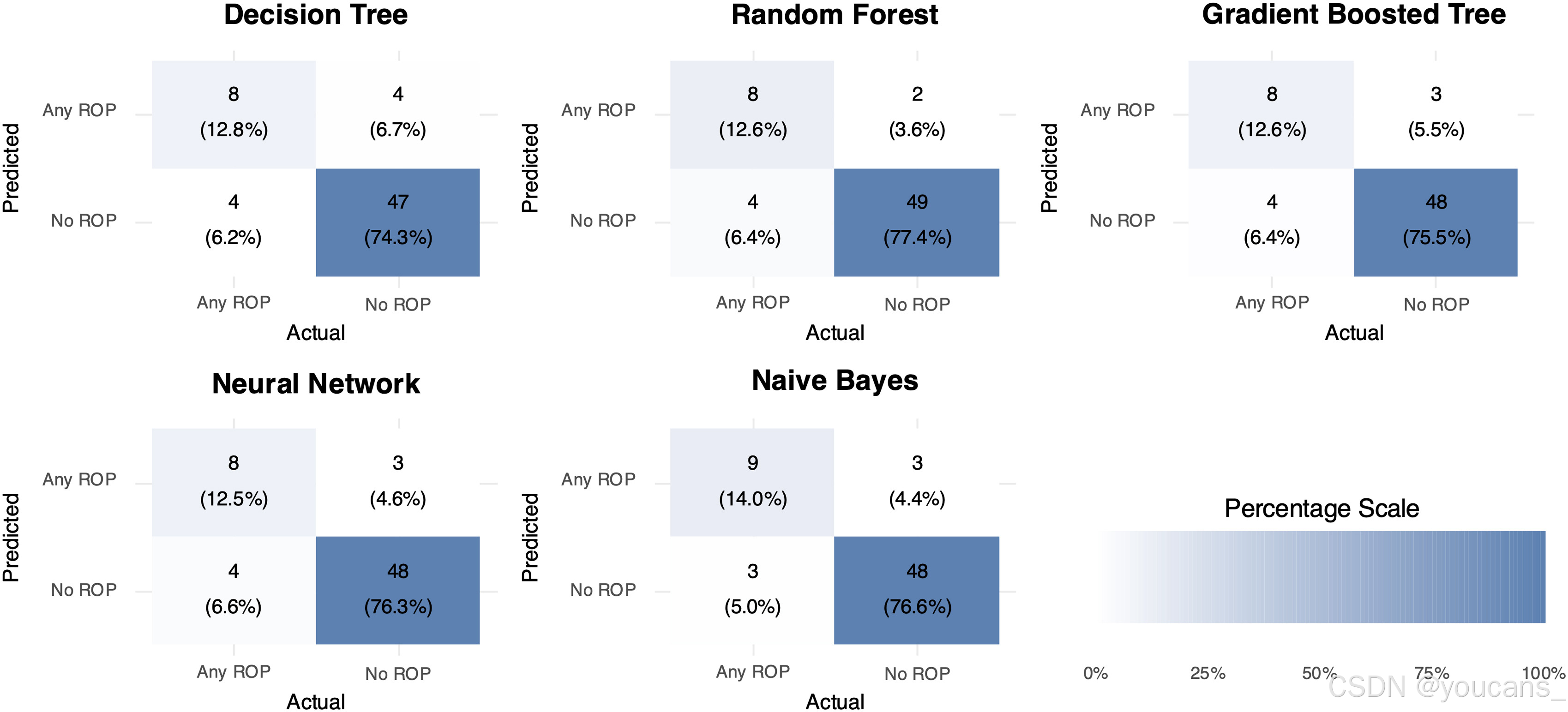
图8:所有五个模型的平均混淆矩阵(200次迭代)。使用caret包的confusion Matrix函数计算了200次迭代的均值混淆矩阵。右下角的颜色条表示百分比刻度。

图9:所有五个模型的平均ROC和PR曲线(200次迭代)200次迭代的平均ROC-曲线(A)和PR曲线是使用pROC和PRROC包的非参数方法生成的。缩写:AUC-PR,精确召回曲线下面积;AUC-ROC,接收器工作特性曲线下的面积。
4. 讨论
近年来,人工智能和机器学习模型在眼科中的应用逐渐增多,尤其是在糖尿病视网膜病变、青光眼和早产儿视网膜病变(ROP)领域。这些新技术有望提高诊断准确性,并减轻临床和经济负担[35-38]。在ROP领域,这些技术的潜在优势可以直接减少全球儿童失明的发生率。
在开发ROP解决方案时,必须考虑两个关键领域:ROP的发生和需要治疗的ROP的发展。前者基于准确的诊断,而后者则建议最佳干预时机。这项在日本山形县进行的多中心观察性研究,旨在利用非成像的表格数据开发ROP发生的预测模型。
我们应用了五种机器学习方法(决策树、随机森林、梯度提升树、神经网络和朴素贝叶斯)对215名接受筛查的新生儿进行了分析。基于200次迭代的结果,这五种机器学习模型表现出色,尽管未使用眼底照片,但其性能优于以往的模型。
先前的研究主要集中在利用逻辑回归、基于评分的模型、体重变化算法或使用眼底照片的深度学习模型来预测ROP的发生。虽然前三种模型在预测需要治疗的ROP方面表现出色,但在预测ROP发生方面仅表现出中等性能(AUC-ROC 0.72–0.89)[10-13]。深度学习模型在预测ROP发生方面表现出高性能(AUC-ROC 0.94),但其需要儿科眼底相机拍摄的眼底照片[14]。 因此,在没有儿科眼底相机的新生儿重症监护室(NICU)中,无法使用基于眼底照片的深度学习模型。我们地区的四个NICU均未配备儿科眼底相机。此外,尽管拍摄眼底照片的负担比眼底镜检查小,但仍对新生儿造成一定的身体负担。我们的机器学习模型不需要眼底照片,也无需承担拍摄图像的相关负担[39]。我们的研究进一步证明了非成像机器学习模型可以可靠地预测ROP的发生。
**我们模型的高性能可能归因于稳健的预测变量选择和迭代测试过程。**鉴于非影像(表格)数据的可用性和较低的成本,我们的研究结果为选择预测模型提供了宝贵的见解。除了确定哪种模型效果最佳外,还需要考虑哪种模型在不同地区或国家以及特殊情况下最实用。这一决策可能取决于当地的医疗成本和医疗服务可及性。例如,没有儿科眼底相机的医疗领域无法使用基于眼底照片的深度学习模型,可能需要探索其他预测模型。此外,对于患有严重角膜混浊的新生儿,由于难以拍摄清晰的眼底照片,基于非影像数据的预测模型可能更为有用。这些考虑可能推动远程医疗系统的发展。
我们的研究存在一些局限性。
样本量215对于机器学习方法来说相对较小,这可能会影响模型的性能和泛化能力。参数调优使用了训练集内的10折交叉验证,这也可能限制我们结果的泛化性。
此外,某些变量(如出生体重和孕周)之间的多重共线性可能影响模型的解释性,并在某些情况下限制其临床适用性。由于担心异常值的影响、确定适当的聚类数量以及降低单个变量的可解释性,我们选择不进行自下而上的层次聚类等预处理方法,尽管这可能改善本研究中的多重共线性问题。尽管如此,随机森林模型、梯度提升模型和朴素贝叶斯模型均实现了较高的AUC-ROC,且95%置信区间相对较窄。
此外,本研究具有地域特异性,仅针对日本山形县。地理限制可能影响我们研究结果在其他人群中的适用性。虽然本研究中使用的35个变量在我们的新生儿护理单元中常规收集,但我们认识到这些变量在其他地区或医疗系统中的可用性可能有所不同。
未来的研究应侧重于开发变量更少的简化模型,以在保持高性能的同时减少数据收集负担,并增强泛化能力和实际适用性。此外,日本的筛查标准(出生体重≤1800克或孕周≤34周)比其他国家的标准(如美国为出生体重≤1500克或孕周≤30周16,英国为出生体重<1501克或孕周<32周40)具有更宽的安全边际。因此,研究中包括了相对较大的低出生体重儿或早产儿,因此在应用于基于其他筛查标准的新生儿之前,需要进一步验证。
最后,我们的研究将预测时间限制在首次眼底检查时。早期预测可能有助于安全管理,但由于预测变量较少,模型性能可能较低。后期预测可能提高预测性能,但可能会错过ROP的早期发展。首次眼底检查是预测ROP发生的实际时间点。
**本研究提出了在首次筛查检查中使用非成像机器学习方法预测ROP发生的可行性。**尽管在样本量、地理区域和筛查标准方面存在局限性,但这些发现对眼科医生和儿科医生具有重要意义,尤其是那些对易于应用且稳健的ROP预测模型感兴趣的人。这些模型在临床环境中(如无法使用眼底相机的情况下)以及未来研究中(作为减少人力和机器工作量的预测模型)具有广阔的应用前景。
6. 参考文献
- Blencowe, H. ∙ Lawn, J.E. ∙ Vazquez, T. …Preterm-associated visual impairment and estimates of retinopathy of prematurity at regional and global levels for 2010
- Kong, L. ∙ Fry, M. ∙ Al-Samarraie, M. …An update on progress and the changing epidemiology of causes of childhood blindness worldwideJ AAPOS. 2012; 16:501-507
- Holmström, G. ∙ Tornqvist, K. ∙ Al-Hawasi, A. …Increased frequency of retinopathy of prematurity over the last decade and significant regional differencesActa Ophthalmol. 2018; 96:142-148
- Ludwig, C.A. ∙ Chen, T.A. ∙ Hernandez-Boussard, T. …The Epidemiology of Retinopathy of Prematurity in the United StatesOphthalmic Surg Lasers Imaging Retina. 2017; 48:553-562
- Löfqvist, C. ∙ Andersson, E. ∙ Sigurdsson, J. …Longitudinal postnatal weight and insulin-like growth factor I measurements in the prediction of retinopathy of prematurityArch Ophthalmol. 2006; 124:1711-1718
- Binenbaum, G. ∙ Bell, E.F. ∙ Donohue, P. …Development of Modified Screening Criteria for Retinopathy of Prematurity: Primary Results From the Postnatal Growth and Retinopathy of Prematurity StudyJAMA Ophthalmol. 2018; 136:1034-1040
- Pivodic, A. ∙ Hård, A.L. ∙ Löfqvist, C. …Individual Risk Prediction for Sight-Threatening Retinopathy of Prematurity Using Birth Characteristics
- Pivodic, A. ∙ E, H.Smith L. ∙ Hård, A.L. …Validation of DIGIROP models and decision support tool for prediction of treatment for retinopathy of prematurity on a contemporary Swedish cohortBr J Ophthalmol. 2023; 107:1132-1138
- Wagner, S.K. ∙ Liefers, B. ∙ Radia, M. …Development and international validation of custom-engineered and code-free deep-learning models for detection of plus disease in retinopathy of prematurity: a retrospective studyLancet Digit Health. 2023; 5:e340-e349
- Eckert, G.U. ∙ Fortes Filho, J.B. ∙ Maia, M. …A predictive score for retinopathy of prematurity in very low birth weight preterm infantsEye. 2012; 26:400-406
- Piermarocchi, S. ∙ Bini, S. ∙ Martini, F. …Predictive algorithms for early detection of retinopathy of prematurityActa Ophthalmol. 2017; 95:158-164
- Ricard, C.A. ∙ Dammann, C.E.L. ∙ Dammann, O.Screening Tool for Early Postnatal Prediction of Retinopathy of Prematurity in Preterm Newborns (STEP-ROP)Neonatology. 2017; 112:130-136
- Coşkun, Y. ∙ Dalkan, C. ∙ Yabaş, Ö. …A predictive score for retinopathy of prematurity by using clinical risk factors and serum insulin-like growth factor-1 levelsInt J Ophthalmol. 2017; 10:1722-1727
- Wu, Q. ∙ Hu, Y. ∙ Mo, Z. …Development and Validation of a Deep Learning Model to Predict the Occurrence and Severity of Retinopathy of PrematurityJAMA Netw Open. 2022; 5, e2217447
- Uemura, Y. ∙ Tsukahara, I. ∙ Nagata, M. …“Diagnostic and Treatment Criteria for Retinopathy of Prematurity” [Translated from Japanese.]The Journal of the Japan Ophthalmologists Association. 1975; 46:553-559
- Fierson, W.M.American Academy of Pediatrics Section on Ophthalmology, American Academy of Ophthalmology, American Association for Pediatric Ophthalmology and Strabismus, American Association of Certified Orthoptists. Screening examination of premature infants for retinopathy of prematurityPediatrics. 2013; 131:189-195
- International Committee for the Classification of Retinopathy of Prematurity. The International Classification of Retinopathy of Prematurity revisitedArch Ophthalmol. 2005;
:991-999 - Early Treatment For Retinopathy Of Prematurity Cooperative GroupRevised indications for the treatment of retinopathy of prematurity: results of the early treatment for retinopathy of prematurity randomized trialArch Ophthalmol. 2003; 121:1684-1694
- caret: Classification and Regression Training. Accessed August 18, 2023. https://cran.r-project.org/web/packages/caret/index.html
- rpart: Recursive Partitioning and Regression Trees. Accessed August 18, 2023. https://cran.r-project.org/web/packages/rpart/index.html
- randomForest: Breiman and Cutler’s Random Forests for Classification and Regression. Accessed August 18, 2023. https://cran.r-project.org/web/packages/randomForest/index.html
- xgboost: Extreme Gradient Boosting. Accessed August 18, 2023. https://cran.r-project.org/web/packages/xgboost/index.html
- nnet: Feed-Forward Neural Networks and Multinomial Log-Linear Models. Accessed August 18, 2023. https://cran.r-project.org/web/packages/nnet/index.html
- klaR: Classification and Visualization. Accessed August 20, 2024. https://cran.r-project.org/web/packages/klaR/index.html
- pROC: Display and Analyze ROC Curves. Accessed August 18, 2023. https://cran.r-project.org/web/packages/pROC/index.html
- PRROC: Precision-Recall and ROC Curves for Weighted and Unweighted Data. Accessed December 16, 2024. https://cran.r-project.org/web/packages/PRROC/index.html
- Binomial Confidence Intervals for Several Parameterizations. Accessed January 15, 2024. https://cran.r-project.org/web/packages/binom/index.html
- iml: Interpretable Machine Learning. Accessed December 15, 2024. https://cran.r-project.org/web/packages/iml/index.html
- Chen, W. ∙ Samuelson, F.W.The average receiver operating characteristic curve in multireader multicase imaging studiesBr J Radiol. 2014; 87, 20140016
- Breiman L, Friedman J, Stone CJ, Olshen RA. Classification and Regression Trees. Taylor & Francis; 1984.
- Breiman, L.Random ForestsMach Learn. 2001; 45:5-32
- Friedman, J.H.Greedy Function Approximation: A Gradient Boosting MachineAnn Stat. 2001; 29:1189-1232
- Cross, S.S. ∙ Harrison, R.F. ∙ Kennedy, R.L.Introduction to neural networksLancet. 1995; 346:1075-1079
- López Puga, J. ∙ Krzywinski, M. ∙ Altman, N.Points of significance: Bayes’ theoremNat Methods. 2015; 12:277-278
- Du, X.L. ∙ Li, W.B. ∙ Hu, B.J.Application of artificial intelligence in ophthalmologyInt J Ophthalmol. 2018; 11:1555-1561
- Ting, D.S.W. ∙ Pasquale, L.R. ∙ Peng, L. …Artificial intelligence and deep learning in ophthalmologyBr J Ophthalmol. 2019; 103:167-175
- Benet, D. ∙ Pellicer-Valero, O.J.Artificial intelligence: the unstoppable revolution in ophthalmologySurv Ophthalmol. 2022; 67:252-270
- Chu, Y. ∙ Hu, S. ∙ Li, Z. …Image Analysis-Based Machine Learning for the Diagnosis of Retinopathy of Prematurity: A Meta-analysis and Systematic ReviewOphthalmol Retina. 2024; 8:678-687
- Moral-Pumarega, M.T. ∙ Caserío-Carbonero, S. ∙ De-La-Cruz-Bértolo, J. …Pain and stress assessment after retinopathy of prematurity screening examination: indirect ophthalmoscopy versus digital retinal imagingBMC Pediatr. 2012; 12:132
- Wilkinson, A.R. ∙ Haines, L. ∙ Head, K. …UK retinopathy of prematurity guidelineEarly Hum Dev. 2008; 84:71-74
版权说明:
本文由 youcans@xidian 对论文 Prediction models for retinopathy of prematurity using non-imaging machine-learning approaches: A regional multicenter study 进行摘编和翻译。该论文版权属于原文期刊和作者,本译文只供研究学习使用。
youcans@xidian 作品,转载必须标注原文链接:
【医学影像 AI】使用非成像机器学习方法预测 ROP 的研究(https://youcans.blog.csdn.net/article/details/146332479)
Crated:2025-03