点击蓝字 关注我们
基于共生菌和基因驱动技术防控蚊媒疾病
中国科学院动物研究所王关红研究员和北京大学生命科学学院Jackson Champer研究员在国际著名期刊Trends in Genetics发表题为“Symbionts and gene drive: two strategies to combat vector-borne disease”的综述文章,系统总结了共生菌和基因驱动技术防控蚊媒疾病的最新研究进展。

https://doi.org/10.1016/j.tig.2022.02.013
蚊虫是疟疾和登革热等人类传染病的重要传播媒介,对全球健康和生命安全造成严重威胁。目前主要采用化学防控策略,因其抗药性的产生及环境污染,急需探索新的经济、安全、可持续的防控策略。共生菌和基因驱动方法作为两种创新型的蚊虫防控策略,例如,基于共生菌方法,沃尔巴克氏菌(Wolbachia)经母系遗传,操纵蚊虫宿主的繁殖,以增强它们的垂直传播。基于基因驱动方法,即改变蚊虫基因,在野生种群中传播驱动等位基因,具有很大的应用潜力。我们总结了两种防控技术的最新研究进展,并比较了两者的独特优势及区别。
正文解读
1. 基于共生菌防控蚊媒疾病
基于自然共生菌和工程菌实现蚊虫防控效果,例如Wolbachia是研究最广泛的基于自然共生菌的蚊虫防控系统,Wolbachia通过母系垂直传播,经雌性化、孤雌生殖或细胞质不亲和性(CI)来操纵宿主繁殖,从而最大限度地限制其传播。当感染Wolbachia的雄性与未感染的雌性交配时,就会诱导CI效应,从而导致产生无法存活的后代。除沃尔巴克氏菌外,其他自然共生菌、特异性病毒、工程菌等对蚊虫控制的研究最近也取得了显著进展(图1)。
基于共生菌防控蚊媒疾病主要包括以下几个方面:
(1)基于细菌的蚊虫防控技术:感染Wolbachia的雄性蚊虫通过CI效应或改变蚊虫种群对病原体产生抗性实现蚊虫种群抑制的效果。沙雷氏菌(Serratia Y1)和亚细亚菌属(Asaia)诱发蚊虫免疫系统,减缓疟原虫发育(图1A)。
(2)基于真菌的蚊虫防控技术:异常威克汉姆酵母(Wickerhamomyces anomalus)通过分泌毒素蛋白对抗疟原虫的发育,白僵菌(Chromobacterium)通过诱导蚊虫免疫系统对抗DENV-2和ZIKV活性(图1B)。
(3)基于特异性病毒的蚊虫防控技术:埃拉特病毒、细胞融合剂病毒、类样病毒和阴性病毒可以单独或联合抑制虫媒病毒的发育(图1C)。
(4)基于工程细菌的蚊虫防控技术:工程细菌沙雷氏菌(Serratia AS1)可以表达抗疟原虫效应蛋白来抑制疟原虫发育。工程菌(Asaia)可诱导蚊虫免疫来防控寄生虫(图1D)。
(5)基于工程真菌的蚊虫防控技术:与野生型蚊虫相比,感染平沙绿僵菌(Metarhizium pingshaense)的蚊虫寿命短且繁殖率低(图1E)。
(6)基于工程病毒的蚊虫防控技术:阴性病毒通过表达一种能抑制CHIKV复制的抗体来实现蚊虫防控的效果(图1F)。
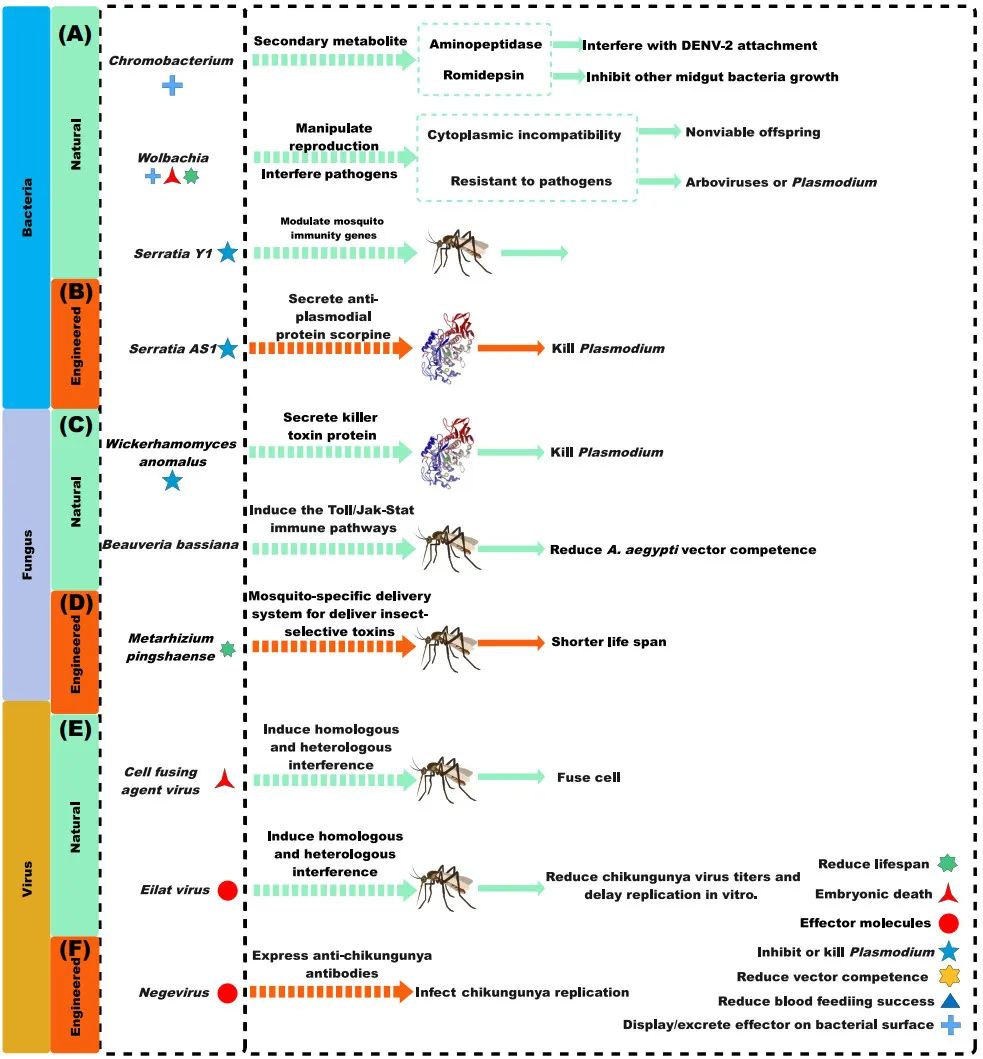
图1 基于共生菌的蚊虫防控方法
2. 基于基因驱动技术防控蚊媒疾病
近年来随着CRISPR技术的出现,基因驱动研究取得了很大的进展。这些设计制造的等位基因在一次适量释放后可以使它们的遗传偏向在蚊子种群中有效传播。基因驱动可分为种群修饰和种群抑制两类。驱动还分为不受限制的驱动类型和受限制在特定目标种群的驱动类型。此外,基因驱动有时可能还有“自我限制”机制(图2)。
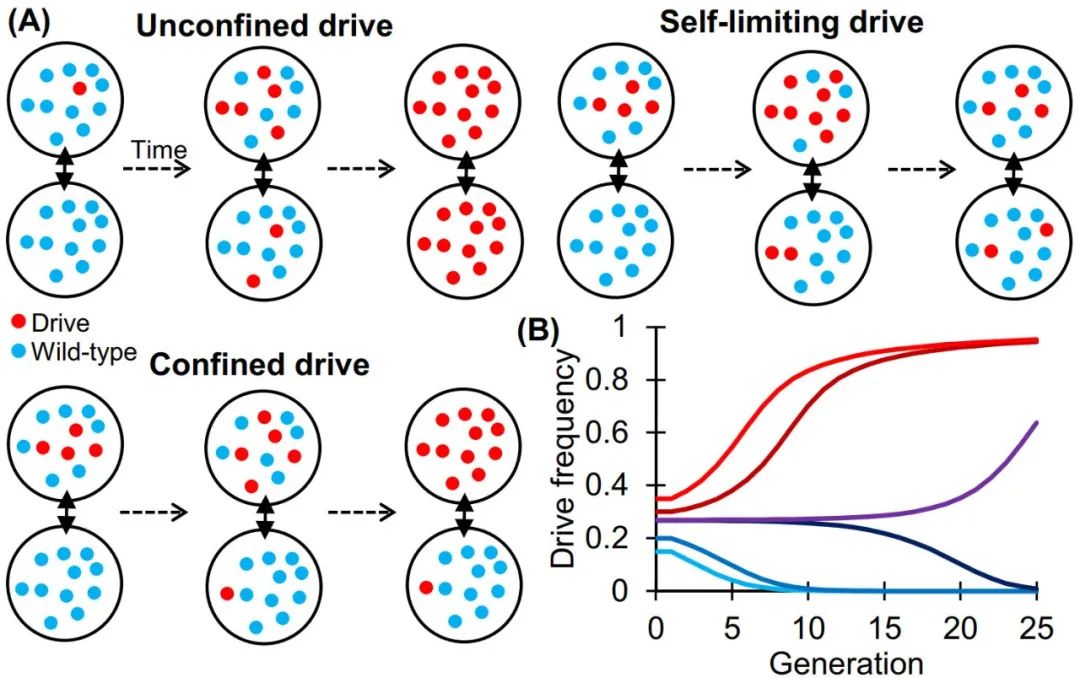
图2 基因驱动的限制
(1)无限制型基因驱动
归巢驱动通过编码核酸内切酶来切割同源染色体中的目标位点并在同源定向修复过程中复制自身。该过程将野生型等位基因转化为杂合子种系中的驱动等位基因,从而增加驱动的遗传性(图3)。驱动使用Cas9与引导RNA,允许高度灵活地靶向天然基因组位点。目前CRISPR归巢驱动的一个关键障碍是它们在Cas9切割后产生抗性等位基因,这会阻止驱动的传播。
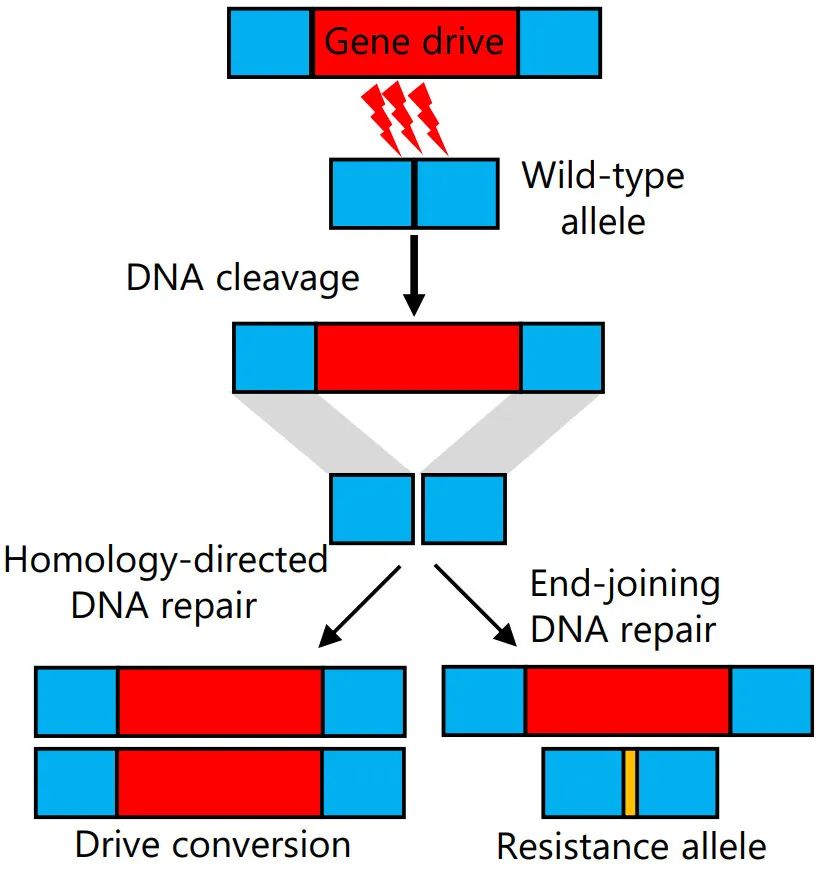
图3 归巢驱动的作用模式图
目前已开发了几种有特定修饰功能的归巢驱动。在斯氏按蚊归巢驱动中,两个表达抗疟抗体的有效载荷基因被设计在靶向kh基因的驱动元件中。该驱动保留了高效率,但也具有较高的胚胎抗性等位基因形成率。
为了克服这个问题,在果蝇中设计了一种救援归巢驱动来靶向单倍致死基因。这个基因的两个功能性拷贝是生存所必需的,因此非功能性抗性等位基因是无法存活的。两个gRNAs可用于防止功能性抗性等位基因的形成。驱动元件包含无法被gRNA切割的靶向基因的重编码拷贝,“救援”了靶向基因的功能。这种驱动成功地消除了抗性等位基因并在笼子种群中进行传播。
归巢驱动可以通过设计靶向必需但单倍充足的基因(无需救援)来抑制种群。在这个系统中,驱动纯合子是不育的或不可存活的,但驱动等位基因仍可在杂合子中传播。目前最常见的种群抑制策略是靶向雌性生殖基因,这可防止去除雄性纯合子中的驱动等位基因,同时仍通过将雌性纯合子进行绝育来迅速抑制种群。
(2)限制型基因驱动
限制型基因驱动有引入阈值,驱动频率需要高于阈值才能增加并达到平衡,低于阈值则会下降并被消除。基于CRISPR系统的毒素-解毒剂驱动通过gRNA靶向必需基因并直接切割和破坏它们来充当毒素,具有靶基因的重编码版本可用作解毒元素。这些驱动靶向单倍充分但是必需的基因,这意味着只有当靶基因的两个野生型拷贝被破坏而没有任何驱动等位基因提供救援时,基因型不能存活。这些系统可能在多个蚊子物种中轻松设计,由于减少了对生殖系Cas9的表达和同源定向修复的要求,因此可能比归巢驱动更容易。
无限制的归巢驱动可能不适合一些特定情况,比如对入侵物种的局部抑制。这种情况下,栓系驱动可以提供归巢驱动的动力,并限制另一个系统。它们可通过缺乏基本组件(如Cas9或gRNA)的归巢驱动系统来构建,缺少的组件由限定驱动提供。
(3)自限型基因驱动
杀手-救援驱动是经典的“自限型”驱动系统,由两个独立的等位基因组成。“杀手”等位基因导致不可存活,除非救援等位基因也存在。
其他自限型驱动系统包括一个分离驱动元件和一个支撑元件。支撑元件的频率不能增加,由于适合度代价,将慢慢从种群中移除。当驱动元件与支撑元件一起,驱动元件的频率可以增加,但最终由于缺乏支撑元件而下降。到目前为止,最常见的分离驱动是缺少Cas9的归巢驱动,Cas9由支撑元件提供。
3. 总结与展望
近年来,随着城镇化、全球贸易、气候变暖等因素的影响,导致蚊虫跨区域传播,缺少高效的蚊虫防控方法加大了虫媒传染病的防控难度,化学防控在起到一定防控效果的同时易引起抗药性的产生,因此,共生菌和基因驱动方法作为两种新的防控策略,在蚊虫防控方面具有强大的应用潜力。研究得到了中国科学院B类先导专项培育项目(XDPB16)等项目的支持。
文章链接:
https://www.cell.com/trends/genetics/fulltext/S0168-9525(22)00040-3
引文链接:
Guan-Hong Wang, Jie Du, Chen Yi Chu, Mukund Madhav, Grant L. Hughes, Jackson Champer. 2022. Symbionts and gene drive: two strategies to combat vector-borne disease. Trends in Genetics https://doi.org/10.1016/j.tig.2022.02.013
作者简介

王关红
研究员,博士生导师,
中国科学院动物研究所农业虫害鼠害综合治理研究国家重点实验室昆虫微生物组学与应用研究组组长
2011-2015年于中国科学院动研究所攻读博士,2015 – 2016年耶鲁大学联合培养博士,2016 - 2019年哈佛大学博士后,2019 - 2021年加州大学圣地亚哥分校博士后,2021年2月至今中国科学院动物研究所研究员。研究组以基因组学为主要手段,基于多组学,基因编辑,微生物分离筛选,无菌体系等方法,探索微生物与宿主互作以及微生物和基因编辑技术对蚊虫进行防控。迄今为止,以第一或通讯作者 (含共同) 在Cell Host & Microbe、Science Advances、Nature Communications等国际著名期刊上发表论文多篇,并获得美国应用专利1项。
实验室网站:http://www.wanglab.com.cn/
联系邮箱:[email protected]

Jackson Champer
北京大学生命科学学院博士生导师
Jackson Champer于1986年出生于美国纽约。他拥有俄勒冈大学物理和数学学士学位和加州大学洛杉矶分校物理学硕士学位。之后,Jackson将工作重点转向生物学,于2015年获得博士学位。2016年至2021年,Jackson是康奈尔大学的博士后研究员。Jackson在2021年5月在北京大学生命科学学院成为博士生导师,从事基因驱动实验方向和生信方向的研究,包括疾病媒介蚊子、模式昆虫果蝇的基因驱动系统的设计。在北京大学生命科学学院和清华大学-北京生命科学联合中心的大力支持下,课题组能够提供先进的实验和计算平台。
实验室网站:https://jchamper.github.io/
联系邮箱:[email protected]
猜你喜欢
10000+:菌群分析 宝宝与猫狗 梅毒狂想曲 提DNA发Nature Cell专刊 肠道指挥大脑
文献阅读:热心肠 SemanticScholar Geenmedical
16S功能预测 PICRUSt FAPROTAX Bugbase Tax4Fun
生物科普: 肠道细菌人体上的生命 生命大跃进 细胞暗战人体奥秘
写在后面
为鼓励读者交流、快速解决科研困难,我们建立了“宏基因组”专业讨论群,目前己有国内外5000+ 一线科研人员加入。参与讨论,获得专业解答,欢迎分享此文至朋友圈,并扫码加主编好友带你入群,务必备注“姓名-单位-研究方向-职称/年级”。PI请明示身份,另有海内外微生物相关PI群供大佬合作交流。技术问题寻求帮助,首先阅读《如何优雅的提问》学习解决问题思路,仍未解决群内讨论,问题不私聊,帮助同行。

学习16S扩增子、宏基因组科研思路和分析实战,关注“宏基因组”
责任编辑:微微